ديپ مايند يكي از بزرگترين چالشهاي زيست شناسي را حل ميكند
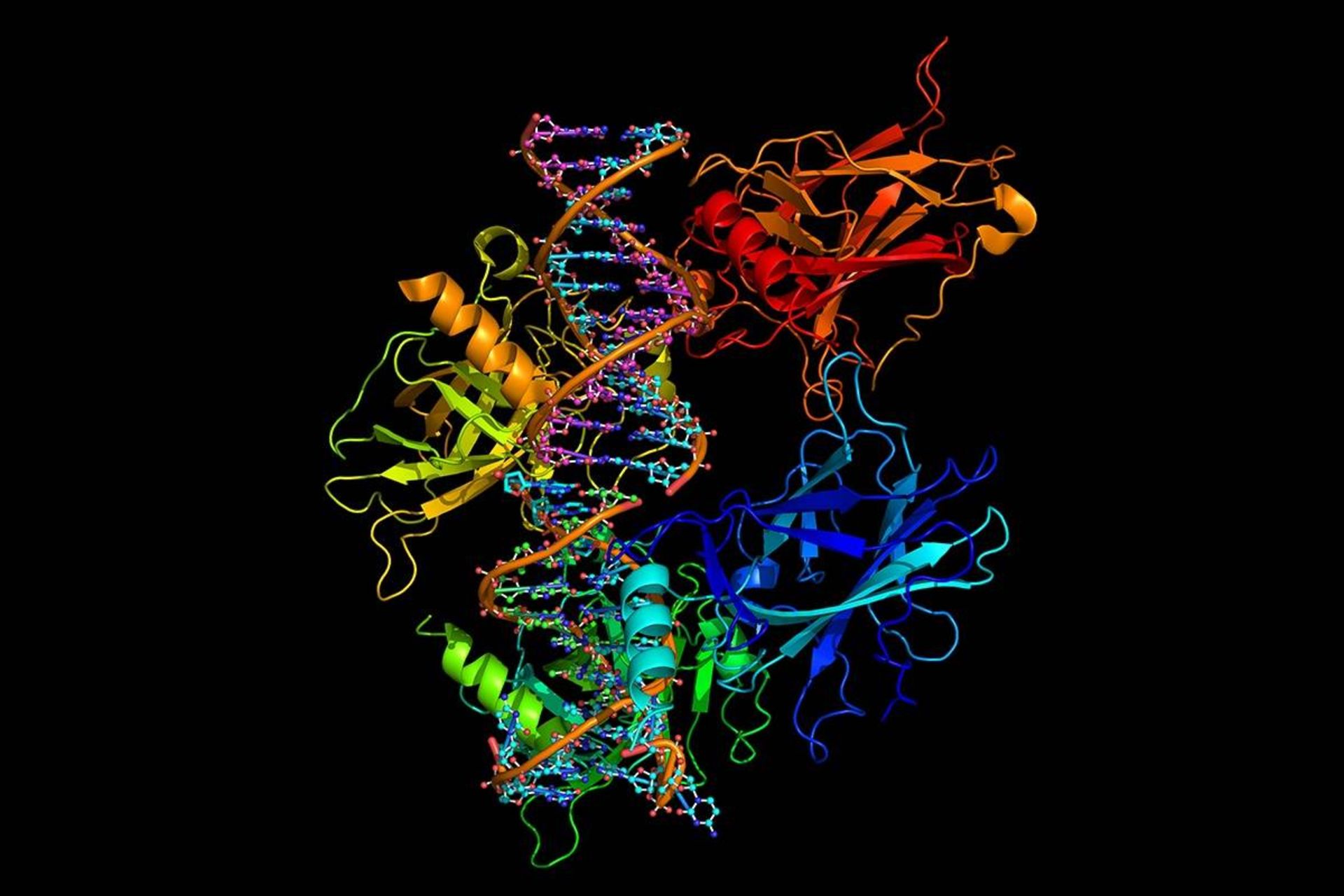
يك شبكهي هوش مصنوعي (AI) كه توسط شاخهي ديپمايند (DeepMind) هوش مصنوعي گوگل ايجاد شده، به پيشرفت عظيمي در زمينهي حل يكي از بزرگترين چالشهاي زيستشناسي يعني تعيين شكل سهبعدي پروتئين براساس توالي آمينواسيدي آن دست پيدا كرده است. برنامهي ديپمايند كه آلفافولد (AlphaFold) نام دارد، در چالش پيشبيني ساختار پروتئين دوسالانهاي به نام CASP (ارزيابي انتقادي پيشگويي ساختار پروتئين) از حدود ۱۰۰ تيم ديگر بهتر عمل كرد. جان مولت، متخصص زيستشناسي محاسباتي در دانشگاه مريلند در كالج پارك، يكي از بنيانگذاران CASP در سال ۱۹۹۴ بود كه با هدف بهبود روشهاي محاسباتي براي پيشبيني دقيق ساختارهاي پروتئين تأسيس شد. او ميگويد: «اين كار بسيار مهمي است. از يك جهت، ميتوان گفت مسئله حل شده است.»
توانايي پيشبيني دقيق ساختارهاي پروتئيني از روي توالي آمينواسيدي آنها مزيت بسيار بزرگي براي علوم زيستي و پزشكي است. اين دستاورد تا حد زيادي تلاش براي درك واحدهاي سازنده سلول را تسريع و كشف سريعتر و پيشرفتهتر داروها را ممكن خواهد كرد.
آلفافولد در CASP گذشته در سال ۲۰۱۸ كه اولين مشاركت ديپمايند مستقر در لندن در اين رقابت بود، در بالاي جدول قرار گرفت. اما امسال اين شبكهي يادگيري عميق كاملا بالاتر از تيمهاي ديگر بود و به گفتهي دانشمندان، عملكرد چنان خوبي داشت كه ميتواند قاصد انقلابي در زيستشناسي باشد. آندري لوپاس، متخصص زيستشناسي تكاملي از مؤسسه زيستشناسي تكويني ماكس پلانك در آلمان كه عملكرد تيمهاي مختلف را در CASP ارزيابي كرد، آن را تحولآفرين خواند. آلفافولد قبلا به لوپاس كمك كرده است ساختار پروتئيني را پيدا كند كه به مدت يك دهه آزمايشگاه او را سردرگم كرده بود و وي پيشبيني ميكند اين پيشرفت باعث تغيير نحوهي كار و سؤالهايي شود كه با آن برخورد ميكند.
در برخي موارد، پيشبينيهاي آلفافولد از موارد حاصل از روشهاي تجربي كه بهعنوان استاندارد طلايي درانديشه متخصصين گرفته ميشود، قابل تمايز نبود: مانند كريستالوگرافي اشعه ايكس يا پراش اشعه ايكس و در سالهاي اخير، كرايو ميكروسكوپي الكتروني (cryo-EM). دانشمندان ميگويند آلفافولد ممكن است نياز به اين روشهاي سخت و گرانارزش را برطرف نكند؛ اما هوش مصنوعي امكان مطالعهي موجودات زنده را به روشهاي جديد فراهم ميكند.
مسئله ساختار پروتئين
پروتئين بهعنوان واحد سازنده حيات، مسئول بيشتر اتفاقاتي است كه درون سلول رخ ميدهد. نحوهي عمل پروتئين و كاري كه انجام ميدهد، بهوسيلهي شكل سهبعدي آن تعيين ميشود. پروتئينها معمولا بدون كمك و فقط براساس قوانين فيزيك شكل خود را به دست ميآورند.
براي چندين دهه، متدهاي آزمايشگاهي اصليترين روش براي دستيابي به ساختارهاي پروتئيني بوده است. اولين ساختارهاي كامل از پروتئينها در دههي ۱۹۵۰ با استفاده از تكنيكي به دست آمد كه در آن پرتوهاي ايكس به پروتئينهاي كريستالشده شليك و نور تفرقيافته به مختصات اتمي پروتئين ترجمه ميشود. كريستالوگرافي اشعه ايكس سهم زيادي در تعيين ساختارهاي پروتئيني داشته است. اما طي دههي گذشته، cryo-EM به ابزار مورد علاقهي بسياري از آزمايشگاههاي فعال درزمينهي زيستشناسي ساختاري تبديل شده است.
مدتها دانشمندان در اين مورد كنجكاو بودهاند كه چگونه اجزاي تشكيلدهندهي پروتئين (رشتهاي از اسيدهاي آمينهي مختلف) پيچوتابهاي شكل نهايي پروتئين را طرحريزي ميكند. تلاشهاي اوليه براي استفاده از كامپيوتر براي پيشبيني ساختارهاي پروتئين در دهههاي ۱۹۸۰ و ۱۹۹۰ عملكرد ضعيفي داشته است و روشهايي كه در مقالات در مورد آنها ادعاهاي زيادي ميشد، وقتي توسط دانشمندان ديگر روي پروتئينهاي متفاوت آزمايش ميشد، حاصلي نداشت.
مولت CASP را باهدف سختگيري بيشتر در مورد اين تلاشها راهاندازي كرد. اين رويداد تيمها را به چالش ميكشد تا ساختارهاي پروتئينهايي را پيشبيني كنند كه با استفاده از روشهاي تجربي حل شده است؛ اما ساختار آنها هنوز دردسترس قرار نگرفته است.
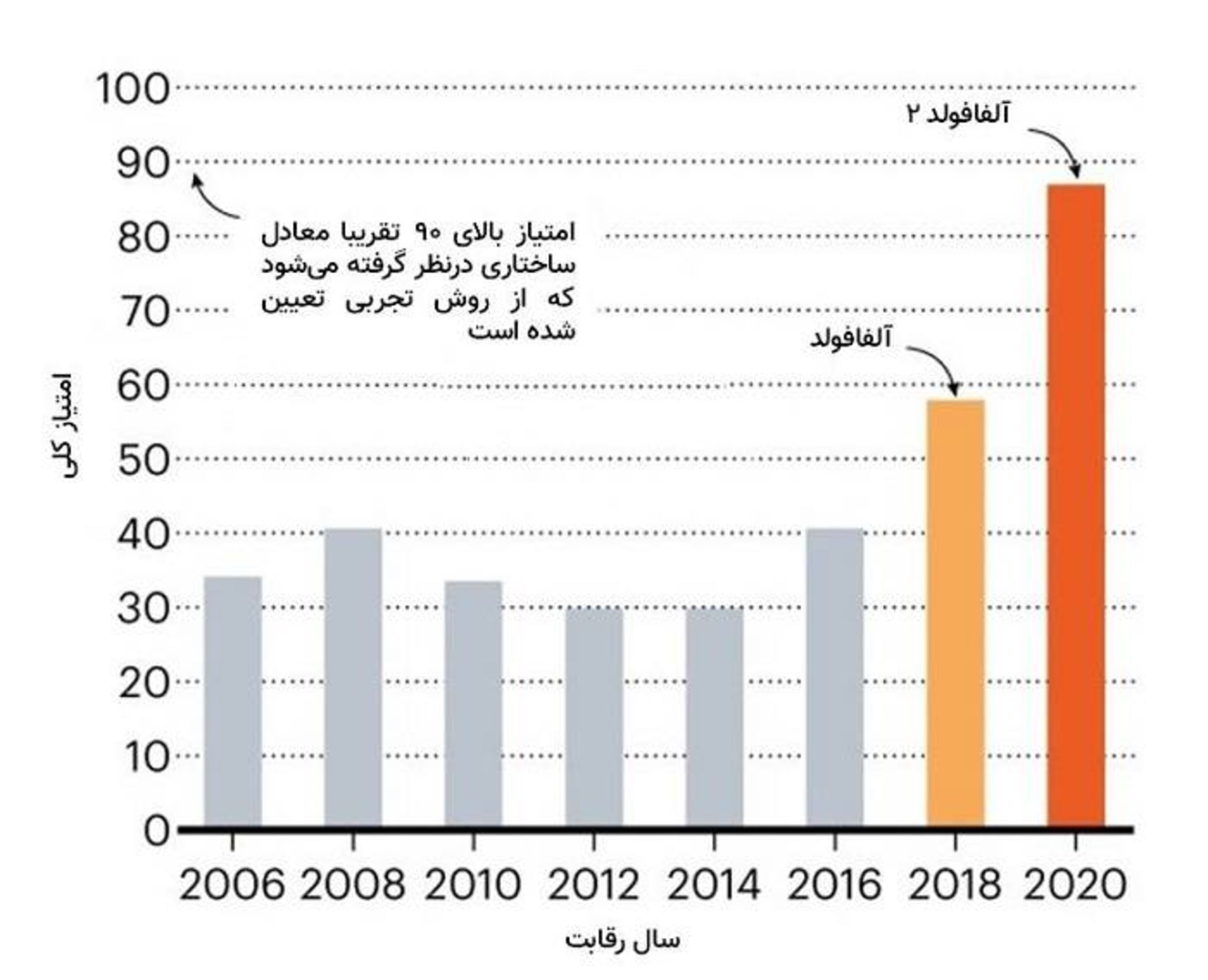
الگوريتم آلفافولد ۲ ديپمايند در رقابت CASP14 در زمينهي پيشبيني ساختار سهبعدي پروتئين بهطور قابلتوجهي نسبت به ديگر تيمها بهتر عمل كرد؛ نسخهي قبلي آن (آلفافولد) نيز در رقابت CASP قبلي نسبتبه گروههاي ديگر عملكرد بهتري داشت
عملكرد سال ۲۰۱۸ ديپمايند در CASP13 موجب تحير بسياري از دانشمندان شد. اولين تكرار آلفافولد، روشي از هوش مصنوعي كه با عنوان يادگيري عميق شناخته ميشود، در مورد دادههاي ژنتيكي و ساختاري به كار ميبرد تا فاصلهي جفتهاي اسيد آمينه در يك پروتئين را پيشبيني كند. جان جامپر كه هدايت پروژه را برعهده داشته است، ميگويد آلفافولد در دومين مرحله كه در آن هوش مصنوعي را فراخواني نميكند، از اين اطلاعات براي تهيهي يك مدل اجماع (consensus model) درمورد پيشبيني شكل پروتئين استفاده ميكند. تيم سعي داشت اين رويكرد را دنبال كند؛ اما درنهايت به بنبست رسيد. بنابراين روند را كاملا تغيير داد و شبكهي هوش مصنوعي را ايجاد كرد كه شامل اطلاعاتي در مورد محدوديتهاي فيزيكي و هندسي مرتبط با نحوهي تاخوردن پروتئينها نيز ميشد. آنها همچنين وظيفهي دشوارتري را براي آن تعيين كردند: شبكه به جاي پيشبيني روابط اسيدهاي آمينه، ساختار نهايي توالي پروتئين هدف را پيشبيني ميكند.
دقت حيرتانگيز
رقابت CASP در طول چند ماه برگزار ميشود. پروتئينهاي هدف يا بخشهايي از پروتئينها كه دومِين ناميده ميشود (درمجموع حدود ۱۰۰ مورد)، با فواصل منظمي منتشر ميشوند و تيمها چند هفته فرصت دارند تا پيشبينيهاي ساختاري خود را ارائه دهند. سپس گروه مستقلي از دانشمندان پيشبينيها را با استفاده از معيارهايي ارزيابي ميكنند و مشخص ميكنند كه پروتئين پيشبينيشده تا چه حد با ساختاري كه به شكل تجربي تعيين شده است، تشابه دارد. ارزيابان نميدانند چه گروههايي اين پيشبينيها را انجام دادهاند.
پيشبينيهاي آلفافولد تحت نام «گروه ۴۲۷» وارد رقابت شد. برخي پيشبينيها بهتر از ديگران بود؛ اما تقريبا دو سوم از پيشبينيها از انديشه متخصصين كيفيت با ساختارهاي تجربي قابل مقايسه بود. مولت ميگويد در برخي موارد، مشخص نبود آيا اختلاف پيشبينيهاي آلفافولد و نتايج تجربي، خطاي پيشبيني است يا حاصل خطاي روش تجربي.
پيشبينيهاي آلفافولد با ساختارهاي تجربي تعيينشده بهوسيلهي تكنيكي به نام تصويربرداري تشديد مغناطيسي هستهاي همخواني ضعيفي داشت كه به گفتهي مولت، ميتواند ناشي از نحوهي تبديل دادههاي خام به مدل باشد.
اين شبكه همچنين در زمينهي مدلسازي ساختارهاي جداگانه به كمپلكسها يا گروههاي پروتئيني به اشكال برميخورد كه به موجب آن، تعامل با پروتئينهاي ديگر اشكال آنها را تغيير ميدهد. مولت ميگويد بهطور كلي، امسال در مقايسه با CASP گذشته، پيشبينيهاي گروههاي مختلف در مورد ساختار پروتئينها دقيقتر بود؛ اما بيشترين پيشرفت را ميتوان مربوط به آلفافولد دانست.
به گفتهي مولت، در مورد اهداف پروتئيني داراي دشواري متوسط، بهترين عملكرد تيمهاي ديگر معمولا از مقياس دقت ۱۰۰ امتيازي، ۷۵ امتياز كسب ميكرد، درحاليكه روي همين اهداف، امتياز آلفافولد حدود ۹۰ بود. مولت ميگويد تقريبا نصف تيمها در خلاصهي رويكرد خود، يادگيري عميق را ذكر كرده بودند كه نشان ميدهد هوش مصنوعي تأثير گستردهاي در اين زمينه از علم خواهد داشت. بيشتر شركتكنندگان گروههاي دانشگاهي بودند؛ اما مايكروسافت و شركت فناوري چيني تنسنت نيز وارد CASP14 شدند.
محمد القريشي، متخصص زيستشناسي محاسباتي از دانشگاه كلمبيا در شهر نيويورك و يكي از شركتكنندگان CASP، مشتاق است كه جزئيات عملكرد آلفافولد در اين رقابت را مورد مطالعه قرار دهد و درمورد نحوهي كار اين سيستم اطلاعات بيشتري كسب كند. او ميگويد احتمال بسيار كمي وجود دارد كه علت عملكرد بالاي اين رويكرد، ساده بودن اهداف پروتئيني باشد؛ اما وي بيشتر بر اين باور است كه آلفافولد تحولآفرين خواهد بود. او ميگويد: «فكر ميكنم منصفانه است كه بگوييم آلفافولد در زمينهي پبيشبيني ساختار پروتئين تحولآفرين خواهد بود. حدس ميزنم افراد زيادي اين زمينه را ترك كنند؛ زيرا به احتمال زياد مسئلهي اصلي حل شده است. »
عملكرد پروتئين بهوسيلهي شكل سهبعدي آن تعيين ميشود
ساختارهاي سريعتر
يكي از پيشبينيهاي آلفافولد به تعيين ساختار نوعي پروتئين باكتريايي كمك كرد كه آزمايشگاه لوپاس سالها در حال تلاش براي كشف آن بود. تيم لوپاس پيش از اين دادههاي خام پراش اشعه ايكس را جمعآوري كرده بود؛ اما تبديل اين الگوهاي لكهمانند به ساختار، نيازمند قدري اطلاعات در مورد شكل پروتئين است. ترفندهايي كه براي به دست آوردن اين اطلاعات استفاده شد و نيز ابزارهاي پيشبيني ديگر با شكست روبهرو شدند. لوپاس ميگويد: «پس از اينكه يك دهه صرف آزمايش هر چيزي كرده بوديم، مدل گروه ۴۲۷ ظرف نيم ساعت ساختار را به ما داد.»
دميس هاسابيس، همبنيانگذار و مدير اجرايي ديپمايند، ميگويد اين شركت قصد دارد آلفافولد را بهمنظور استفادهي دانشمندان ديگر اصلاح كند. ممكن است چند روز طول بكشد تا آلفافولد ساختار پيشبينيشدهاي ارائه دهد كه شامل برآوردهاي مربوط به قابليت اعتماد مناطق مختلف پروتئين ميشود. هاسابيس كه كشف دارو و طراحي پروتئين را از متخصصدهاي بالقوه روش خود ميداند، ميافزايد: «ما تازه شروع به درك چيزي كردهايم كه زيستشناسان بهدنبال آن هستند.»
در اوايل سال ۲۰۲۰، اين شركت پيشبينيهايي از ساختارهاي چند پروتئين SARS-CoV-2 منتشر كرد كه هنوز با استفاده از روش تجربي تعيين نشده بود. استفان بروهاون، متخصص عصبزيستشناسي مولكولي از دانشگاه كاليفرنيا كه تيمش ساختارهاي مذكور را در ماه ژوئن منتشر كرد، ميگويد پيشبينيهاي ديپمايند در مورد پروتئيني بهنام Orf3a، بسيار شبيه چيزي بود كه بعدا با استفاده از cryo-EM تعيين شد.
تأثير در دنياي واقعي
بعيد است كه آلفافولد موجب توقف كار آزمايشگاههايي مانند آزمايشگاه بروهاون شود كه از روشهاي تجربي براي حل ساختارهاي پروتئيني استفاده ميكند. اما اين دستاورد ميتواند به معناي آن باشد كه دادههاي تجربي داراي كيفيت پايينتر و از انديشه متخصصين جمعآوري سادهتر، تمام چيزي خواهند بود كه براي رسيدن به ساختاري مناسب لازم هستند.
برخي متخصصدها نظير تجزيهوتحليل تكاملي از پروتئينها ممكن است رونق بگيرد؛ زيرا حجم عظيمي از دادههاي ژنومي دردسترس است كه ممكن است بتواند بهطور قابل اعتمادي به ساختار تبديل شود. جانت تورنتون، متخصص زيستشناسي ساختاري و يكي از ارزيابهاي CASP گذشته، ميگويد: «فكر ميكردم اين مسئله در طول زندگي من حل نخواهد شد.» او اميدوار است اين روش بتواند به آشكار شدن عملكرد هزاران پروتئين حلنشده در ژنوم انسان كمك كند و تغييرات ژني عامل بيماري را كه در افراد متفاوت است، معنا كند.
عملكرد آلفافولد نقطهي عطفي براي ديپمايند محسوب ميشود. اين شركت به خاطر دارا بودن هوش مصنوعي مسلط بر بازيهايي مانند گو مشهور است؛ اما هدف بلندمدت آن توسعهي برنامههايي بوده است كه بتواند به هوش كلي نظير هوش انسان دست پيدا كند. هاسابيس ميگويد حل چالشهاي علمي بزرگ مانند پيشبيني ساختار پروتئين، يكي از مهمترين متخصصدهايي هوش مصنوعي آنها است.
هم انديشي ها