رقابت پژوهشگران براي يافتن داروهاي ضدويروسي براي مبارزه با كوويد ۱۹
مارس ۲۰۲۰، هنگامي كه دامنهي دنياگيري كوويد ۱۹ درحال آشكار شدن بود، جن نوانكو و همكارانش، دو برنامهي هوش مصنوعي را درجهت مبارزه با ويروس كروناي SARS-CoV-2 به كار گرفتند. يكي از اين برنامهها، SUEDE است كه تمام تركيبات شناختهشدهي دارومانند را بهدنبال فعاليت احتمالي دربرابر مولكولهاي زيستي جستوجو ميكند كه تصور ميشود در بيماري نقش داشته باشند. برنامهي ديگر كه BAGEL نام دارد، نحوهي ساخت بازدارندهها براي اهداف شناختهشده را پيشبيني ميكند. هر دو برنامه بهدنبال تركيباتي ميگردند كه بتوانند آنزيمهاي انساني را كه نقشهاي مهمي در قادر ساختن ويروس در آلوده كردن سلولها دارند، مهار كنند.
دو برنامهي مذكور با جستجوي تركيبات مختلف، مواردي را كه بهانديشه متخصصين ميرسيد مؤثر باشند، پيشنهاد كردند. نوانكو، مديرعامل استارتاپ 1910 Genetics، از شركتي فعال درزمينهي مواد شيميايي خواست تا اين تركيبات را بسازد. حدود يك هفته بعد، گروه او سفارشها را دريافت كرد و به نوبت هريك از تركيبات را به سلولهاي انساني افزود و متوجه شد كه هريك از آنها هدف خود را مهار كرده و از ورود ويروس به سلولهاي جلوگيري ميكنند. اين شركت اكنون بهدنبال همكاري با سازندگان داروهاي ضدويروسي است تا كارآزماييهاي حيواني و انساني را دنبال كنند. نوانكو ميگويد هوش مصنوعي طراحي دارو را تسريع ميكند.
طراحي و ساخت دارو تقريبا هميشه بهشدت كند بوده است و درحالت عادي حداقل يك دهه طول ميكشد. بسياري از مراحل مانند مطالعات حيواني، اصلاح مولكولها براي پيشگيري از عوارض جانبي و كارآزماييهاي باليني را نميتوان با شتاب انجام داد.
رقابت براي دستيابي به درمان جديد عليه كوويد ۱۹ موجب همكاري گروههاي پژوهشي مختلف و استفاده از تمام ابزارهاي ممكن شده است و پژوهشها با سرعت زيادي درحال انجام است. طبق يك گزارش، حدود ۲۳۹ مولكول ضدويروس عليه كوويد ۱۹ در دست ساخت است كه چندين بخش از چرخهي زندگي ويروس را مورد هدف قرار ميدهند.
ثابت شده است كه ضدويروسها در مبارزه دربرابر عفونتهاي ديگري مانند HIV و هپاتيت C حياتي هستند. با وجود اجراي برنامهي واكسيناسيون كوويد ۱۹، چنين داروهايي در مبارزه با ويروس كروناي عامل دنياگيري نيز حياتي خواهند بود. مارك دنيسون، ويروسشناس دانشگاه وندربيلت ميگويد: «همه نميتوانند واكسن را دريافت كنند يا در برابر آن پاسخ دهند». همچنين اثربخشي واكسنها با ظهور گونههاي جديد ويروس و كاهش محافظت ايمني، ممكن است كم شود. بنابراين، ادامهي تلاش براي ساخت ضدويروسها مهم است.
تا امروز، بيشتر تلاشهاي جستوجو براي تركيبات دارويي مؤثر دربرابر كوويد، روي مواردي تمركز داشته است كه در ابتدا براي مبارزه با بيماريهاي ديگر ساخته شدند. يكي از اين موارد، استروئيد دگزامتازون است كه بهجاي خود ويروس، واكنش بدن دربرابر عفونت را مورد هدف قرار ميدهد. نوانكو ميگويد: «تغيير متخصصي دارو اولين راهحل منطقي است. بسياري از داروهاي ضدويروسي در مطالعات سلولي و حيواني دربرابر SARS-CoV-2 اميدواركننده بودهاند و اكنون در كارآزماييهاي باليني قرار دارند». يكي از ضدويروسها، رمدسيوير است كه نشان داده شده است در افراد بسيار بيمار روند بهبودي را تسريع ميكند. اما چند داروي ضدويروس ديگر كه مورد آزمايش قرار گرفتهاند، نتيجهاي حاصل نكردهاند.
با پيشرفت سريع در درك SARS-CoV-2 و افزايش شمار تركيبات جديدي كه ممكن است اين ويروس را مهار كنند و كارآزماييهاي درحال پيشرفتي كه برخي از آنها در مراحل پاياني قرار دارند، برخي دانشمندان اميدوارنند كه امسال داروهاي موثري دربرابر اين عفونت پيدا شود. اندرو مسيكر زيستشناس دانشگاه پردو ميگويد: «اطمينان دارم كه درمانهاي بيشتري براي ويروس كرونا خواهيم داشت».
كد ژنتيكي ويروس SARS-CoV-2 حدود ۳۰ هزار حرف RNA دارد كه نسبتبه بسياري از ويروسهاي ديگر بيشتر است. اين حروف كدكنندهي ۲۹ پروتئين ويروسي است كه ويروس را قادر ميسازد تا سلولها را عفوني كند، تكثير شود، فرار كند و انتشار پيدا كند. ساندرا ولر، زيستشناس دانشگاه كنتيكت ميگويد: «خوشبختانه اين ويروس اهداف زيادي در اختيار ما ميگذارد، بنابراين فرصتهاي زيادي براي مداخله وجود دارد».
۲۹ پروتئين در سه دستهي اصلي قرار ميگيرند: پروتئينهاي ساختاري كه پوشش بيروني را تشكيل ميدهند، پروتئينهاي غيرساختاري كه بيشتر آنها به تكثير ويروس كمك ميكنند و پروتئينهاي كمكي كه چند مورد از آنها بهانديشه متخصصين ميرسد پاسخ ايمني ميزبان را مهار ميكنند. تاكنون، جويندگان دارو عمدتا پروتئينهاي ساختاري و تكثيري را مورد هدف قرار دادهاند و بر مولكولهايي تمركز كردهاند كه شبيه مولكولهايي هستند كه در مبارزه با ويروسهاي ديگر نتيجهبخش بودهاند.
ويروس SARS-CoV-2 فقط چهار پروتئين ساختاري دارد. پروتئينهاي پوشش و غشا، پوستهي كروي ويروس را تشكيل ميدهند و پروتئين نوكلئوكپسيد از ژنوم محافظت ميكند. پروتئين چهارم يعني اسپايك از پوستهي ويروس به حالت برجسته بيرون آمده است و به ويروس كمك ميكند تا به گيرندههاي ACE2 متصل شود كه محل اصلي ورود ويروس به سلول است. اسپايك هدف اصلي بسياري از واكسنها و ضدويروسها است. اگرچه، مولكولهاي كوچك، يعني تمركز معمول برنامههاي كشف دارو، مؤثر نيستند، زيرا به اندازهي كافي بزرگ نيستند كه مانع از اتصال اسپايك به گيرندهي ACE2 شوند.
ديويد بيكر، زيستشناس دانشگاه واشينگتن و همكارانش به پروتئينهاي كوچك يا مينيپروتئينها روي آوردهاند كه هركدام حدود ۶۰ اسيد آمينه دارد و براي پيشگيري از تعاملات پروتئين با پروتئين طراحي شدهاند. در اواخر سال ۲۰۲۰، گروه بيكر مينيپروتئينهايي را توصيف كردند كه براي اتصال محكم با پروتئين اسپايك ويروس و ممانعت از اتصال آن به گيرندهي ACE2 طراحي شده بودند. در شرايط آزمايشگاه، پروتئينهاي ريز مانع از اين ميشدند كه ويروس سلولهاي انسان را آلوده كند و بيكر ميگويد مينيپروتئينها ميتوانند داروهاي ايدهآلي را بسازند زيرا نسبتبه درمانهاي پروتئيني معمول مانند آنتيباديها پايدارتر هستند.
پژوهشگران ديگر استراتژي متفاوتي را براي ايجاد اختلال در فرايند اتصال ويروس دنبال ميكنند. آنها درحال طراحي مولكولهايي شبيه ACE2 هستند كه بهعنوان طعمه عمل كند و ويروس SARS-CoV-2 را از سلولها دور كند. براي مثال، پژوهشگران شركت Neoleukin Therapeutics مينيپروتئيني به نام CTC-445.2d را ساختهاند كه گرايش زيادي براي اتصال به اسپايك دارد.
اين تركيب در شرايط آزمايشگاهي از سلولهاي انساني دربرابر عفونت محافظت كرد و مانع از ابتلاي همسترهايي كه دوز كشندهاي از ويروس را دريافت كرده بودند، به بيماري شديد شد. يكي ديگر از اين نوع مولكولها كه در نوامبر ۲۰۲۰ در مجلهي Proceedings of the National Academy of Sciences گزارش شد، نيز در لولهي آزمايش SARS-CoV-2 را منحرف كرد و مانع از اين شد كه سلول را آلوده كند.
ويروس پس از وارد شدن به سلول ميزبان، آن را به كارخانهي توليد ويروس تبديل ميكند. اينجا است كه پروتئينهاي غيرساختاري ويروس وارد عمل ميشوند. پروتئينهاي ويروسي به كمك كارخانههاي پروتئينسازي ميزبان يعني ريبواخبار تخصصيها ساخته ميشوند كه RNA ويروسي را به دو زنجيرهي طولاني پليپروتئين ترجمه ميكند. اين زنجيرهها، دو پروتئين كوچكتر به نامهاي NSP3 و NSP5 را ميسازند كه آنزيمهاي پروتئاز برشدهندهي پروتئين هستند كه پليپروتئينهاي ديگر را به پروتئينهاي مستقل و عملكردي خرد ميكنند. به گفتهي دنيسون، اينها عملكردها بسيار مهمي هستند و بهشدت محافظت ميشوند و بايد دربرابر ضدويروسها بسيار آسيبپذير باشند.
داروهاي مهاركنندهي پروتئازها با موفقيت دربرابر HIV و هپاتيت C عمل كردهاند و از محبوبترين ضدويروسهاي كانديدا براي مبارزه در برابر SARS-CoV-2 هستند. دو مهاركنندهي پروتئاز به نامهاي لوپيناوير و ريتوناوير كه ابتدا براي درمان HIV ساخته شدند، در شرايط آزمايشگاهي دربرابر SARS-CoV-2 نتايج اميدبخشي حاصل كردند، اما در اكتبر ۲۰۲۰، كارآزمايي بزرگي در بريتانيا نشان داد كه فايدهاي ندارند.
پژوهشگران شركت دارويي فايزر مهاركنندهاي را دنبال ميكنند كه ممكن است عملكرد بهتري داشته باشد، زيرا براي هدف قرار دادن NSP5 طراحي شده است كه پروتئاز اختصاصي SARS-CoV-2 و ويروسهاي كروناي خويشاوند آن است. دانشمندان فايزر داروي خود را در سال ۲۰۰۳ براي مهار مولكول مذكور كه پروتئاز اصلي (Mpro) نيز ناميده ميشود، در سندرم تنفسي حاد (سارس) ايجاد كردند كه ناشي از ويروس كروناي ديگري بود.
وقتي همهگيري سارس به پايان رسيد، كار روي دارو متوقف شد. اكنون فايزر اين تركيب را دوباره مورد آزمايش قرار داده است و متوجه شده است كه مانع از تكثير SARS-CoV-2 درون سلولهاي انساني ميشود. پژوهشگران فايزر نسخهي محلولتري از اين ساختار را ايجاد كردهاند كه PF-07304814 ناميده ميشود. آنها نشان دادهاند كه اين تركيب بار ويروسي را در موش بهشدت كاهش ميدهد. در حيوانات ديگر، غلظتهاي بالايي از دارو ميتواند به بافتها برسد.
سپتامبر ۲۰۲۰، فايزر كارآزمايي باليني كوچكي را براي آزمايش ايمني PF-07304814 آغاز كرد كه ازطريق وريدي به بيمار تزريق ميشود. اما آناليزا آندرسون، سرپرست برنامه توسعهي داروي ضدويروس در شركت فايزر، ميگويد بهكارگيري داوطلبان كارآزمايي دشوار بوده است. بيماران يا بهشدت بدحال هستند و ممكن است استفاده از دارو براي آنها خيلي دير باشد (براي پيشگيري از تكثير ويروس) يا ممكن است خيلي بيمار نباشند و درمان داخل وريدي براي آنها جذابيت كمتري داشته باشد.
پژوهشگران ديگر نيز درحال كار روي مهاركنندههاي Mpro هستند. پژوهشگران در چين در سپتامبر ۲۰۲۰ در مجلهي Nature Communications استفاده از بوسپروير و GC376 را گزارش كردند. بوسپروير داروي هپاتيت C است درحاليكه GC376 براي هدف قرار دادن يكي از ويروسهاي كروناي گربهسانان طراحي شده است. هر دو تركيب تكثير SARS-CoV-2 را در سلولها كند كردند.
۵ فوريه، پژوهشگران در پيشچاپي گزارش كردند كه بيشتر موشهايي كه پس از دريافت دوز كشندهاي از ويروس عامل دنياگيري، داروي GC376 را دريافت كردند، زنده ماندند. پژوهشگران آمريكايي نيز در آگوست ۲۰۲۰ در مجلهي Science Translational Medicine، آنالوگي از GC376 را توصيف كردند كه در موشهاي آلوده به ويروس سندرم تنفسي خاورميانه نرخ ماندگاري را به ميزان قابلتوجهي افزايش داد و در سلولها اثرات ضدويروسي قوي دربرابر SARS-CoV-2 نشان داد.
مولكولهاي ديگري كه بهطور خاص براي مهار Mpro ويروس SARS-CoV-2 طراحي شدهاند، در مراحل اوليهي آزمايش قرار دارند. بهعنوان مثال، شارلوت لانتري، ميكروبشناس مؤسسه تحقيقات والتر ريد در نوامبر ۲۰۲۰ گزارش كرد كه به كمك هوش مصنوعي ۴۱ ميليون تركيب را مورد غربالگري داده و ۸۰۷ مهاركنندهي Mpro را كشف كردهاند. گروه وي هفت مورد را اميدواركننده توصيف كرده است اما تبديل آنها به دارو چند سال طول ميكشد. وي و همكارانش همچنين بهدنبال داروهاي ضدويروس مؤثر دربرابر تمام ويروسهاي كرونا هستند.
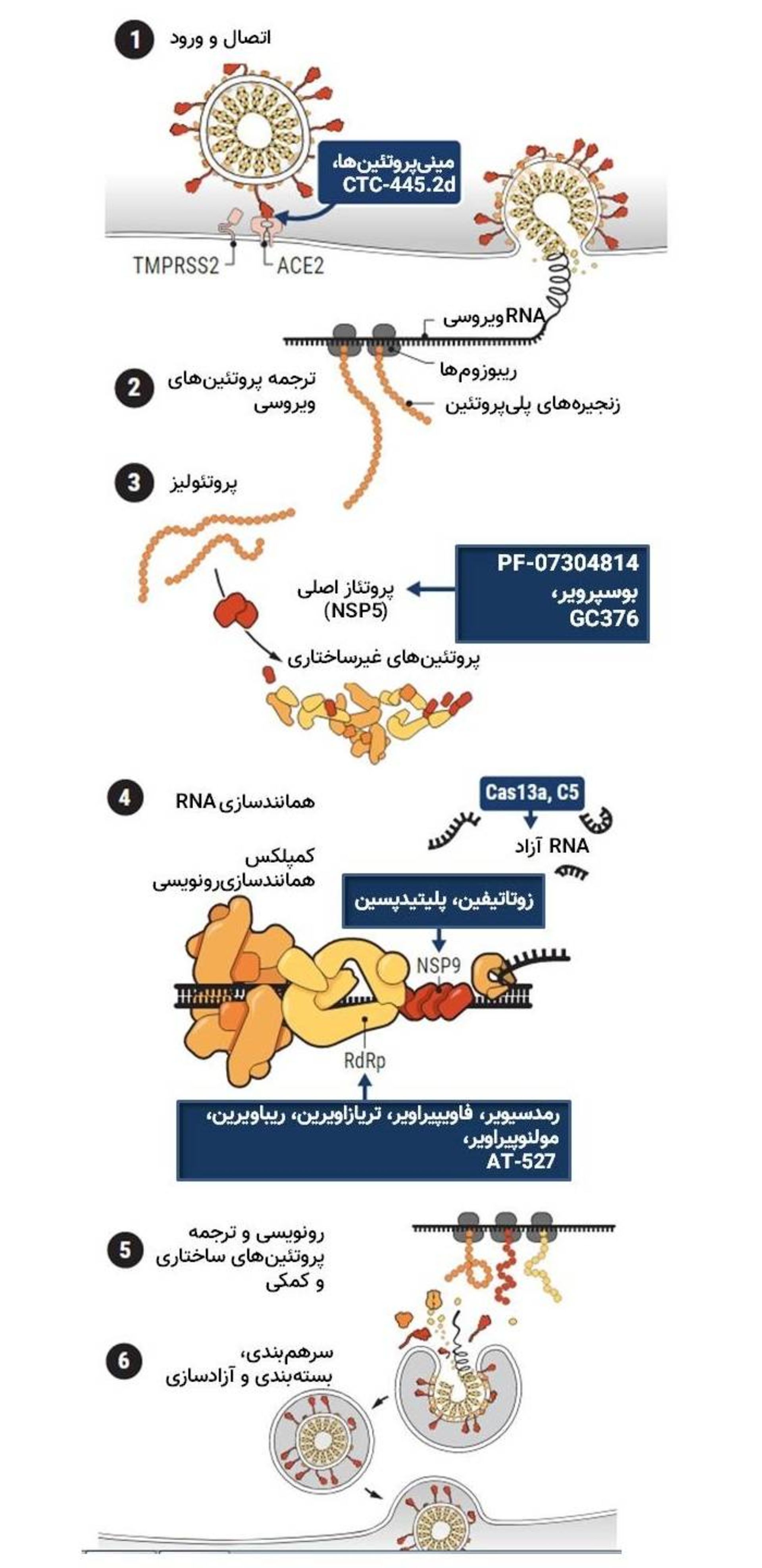
ويروس كرونا براي عفونيكردن سلولها، تكثير و انتشار خود به چندين پروتئين ميزبان و ويروس متكي است. اين پروتئينها مجموعهاي از اهداف را براي داروهاي كانديدا (جعبههاي آبي) مهيا ميكنند كه هدف آنها مهار پروتئينهاي مهم براي مراحل مختلف چرخهي زندگي ويروس SARS-CoV-2 است.
پس از اينكه پروتئازهاي SARS-COV-2 پروتئينهاي ويروس كرونا را از زنجيرههاي اصلي آزاد ميكنند، ۱۵ مورد از آنها گرد هم ميآيند تا كمپلكس همانندسازيرونويسي (RTC) را تشكيل دهند كه از ژنوم ويروس براي ساخت ويروسهاي جديد نسخهبرداري ميكند. هستهي اصلي اين ماشينآلات، NSP9 است كه براي ايجاد نسخهي جديدي از RNA، به رشتهي RNA ويروس و RNAپليمراز وابسته به RNA (به اختصار RdRp) متصل ميشود.
نقش حياتي كمپلكس همانندسازيرونويسي موجب شده است كه اين كمپلكس و خصوصا RdRp محبوبترين اهداف دارويي باشند. اين همان جايي است كه رمدسيوير عمل ميكند. رمدسيوير يك آنالوگ نوكلئوزيدي است و از آدنوزين كه يكي از حروف تشكيلدهندهي RNA است، تقليد ميكند و موجب ميشود RdRp بهجاي آدنوزين، مولكولهاي رمدسيوير را وارد رشتهي درحال طويل شدن RNA كند و با ايجاد اختلال در عمل RdRp، تكثير ويروس متوقف شود.
پژوهشگران اميدوار هستند كه آنالوگهاي نوكلئوتيدي و نوكلئوزيدي ديگري كه براي اهداف ديگر طراحي شدهاند، بتوانند دربرابر ويروس كرونا مؤثر باشند (نوكلئوتيدها نوكلئوزيدهايي هستند كه يك يا چند گروه فسفات به آنها اضافه شده است). اين كانديداها شامل فاويپيراوير و تريازاويرين كه هر دو در اصل براي مبارزه با ويروسهاي آنفلوانزا طراحي شدهاند، ريباويرين كه درماني كه براي ويروس سينسيشيال تنفسي و هپاتيت C است و گاليدسيوير كه ميتواند تكثير ويروسهاي ابولا، زيكا و تب زرد را مهار كند، ميشوند.
پژوهشگران درمورد مولنوپيراوير خوشبين هستند كه آنالوگ نوكلئوزيدي است كه ميتواند بهصورت قرص مصرف شود و در ابتدا براي مبارزه با آنفلوانزا ساخته شد. سال گذشته، پس از اينكه افشاگري انتقاد كرد كه شاهد تلاش نامناسبي براي هدايت بودجه دولت براي آن بوده است، نگرانيهايي درمورد اين دارو ايجاد شد. اما نتايج مثبت موجب ادامهي پيشرفت شد.
پژوهشهاي اوليه نشان داد كه مولنوپيراوير خود را بهجاي نوكلئوزيد سيتيدين وارد DNA ميكند و موجب ايجاد اشتباهاتي در فرايند نسخهبرداري و تجمع مرگباري از جهشها در ويروس ميشود. اين مكانيسم موجب نگراني دراينباره شده است كه مولنوپيراوير ممكن است موجب جهشهاي مشابهي در سلولهاي ميزبان شود. اما ريچارد پلمپر، زيستشناس دانشگاه ايالتي جورجيا ميگويد چنين اشكالاتي در مطالعات حيواني ديده نشده است.
آوريل ۲۰۲۰، دنيسون و همكارانش در مجلهي Science Translational Medicine گزارش كردند كه مولنوپيراوير در موشها، تكثير چندين ويروس كرونا ازجمله SARS-CoV-2 را بهشدت كاهش داد. داروي مذكور همچنين تكثير SARS-CoV-2 را در سلولهاي پوششي مجاري هوايي انسان متوقف كرد. مقالهاي كه در مجلهي Nature منتشر شد، به دادههاي اميدواركننده در اين زمينه افزود و نشان داد اين تركيب در موشهاي مهندسيشده براي داشتن بافت ريه انسان، تكثير ويروسي را تا ۱۰۰ هزار برابر كاهش داد.
پلمپر و همكارانش در دسامبر ۲۰۲۰ در مجلهي Nature Microbiology گزارش كردند كه مولنوپيراوير ممكن است كاري بيش از پيشگيري از علائم انجام دهد. پژوهشگران اين دارو را به راسوي اهلي دادند كه بهسادگي ويروس كرونا را منتشر ميكند و طي ۲۴ ساعت ميزان انتقال به صفر رسيد.
يكي از مزيتهاي مولنوپيراوير اين است كه دارويي خوراكي است و ازآنجا كه به شكل قرص است، آن را ميتوان در اوايل چرخهي بيماري تجويز كرد يعني زمانيكه معمولا تكثير SARS-CoV-2 به اوج خود ميرسد. اين درحالي است كه داروهاي تزريقي مانند رمدسيوير ديرتر به بيماران داده ميشود. پلمپر ميگويد: «مي خواهيم درمان را زود شروع كنيم و نگذاريم كار افراد به بيمارستان بكشد».
پيشچاپي در medRxiv نيز گزارش كرد كه در كارآزمايي باليني ايمني كوچكي، مولنوپيراوير به خوبي تحمل شد و عوارض جانبي جدي در داوطلبان سالم رخ نداد. مولنوپيراوير اكنون در كارآزماييهاي باليني مرحلهي دوم/سوم قرار دارد. در ماه مارس، دانشمندان در جلسهاي گزارش كردند كه مولنوپيراوير سطح ويروسي بيماران را كاهش داد. آنالوگ نوكلئوزيدي خوراكي ديگري كه AT-527 نام دارد و براي درمان هپاتيت C ساخته شده است، نيز در كارآزمايي باليني مرحلهي دوم دربرابر كوويد ۱۹ قرار دارد.
برخي دانشمندان درحال تلاش براي توقف ديگر پروتئينهاي كمپلكس همانندسازيرونويسي هستند. در نتايجي كه اخيرا گزارش شده است، بهانديشه متخصصين ميرسد دو تركيب (زوتاتيفين و پليتيدپسين) با ايجاد اختلال در عمل NSP9 يعني آنزيمي كه به RNA متصل ميشود، تكثير ويروس را مهار ميكنند. پليتيدپسين در كارآزمايي مرحلهي دوم/سوم توسط شركت اسپانيايي PharmaMar قرار دارد.
درنهايت، داروها ميتوانند نهتنها پروتئينها بلكه RNA ويروس كرونا را مورد هدف قرار دهند. در ماه فوريه، املين بلانچارد و همكارانش در مجلهي Nature Biotechnology گزارش كردند كه فرمولاسيوني از آنزيم ويرايشگر ژن Cas13a را ايجاد كردهاند كه قطعات RNA ويروس كرونا را مورد جستوجو قرار داده و خرد ميكند. آنزيم Cas13a مناطق بسيار محافظتشده از دو ژن ويروسي را كه كدكنندهي آنزيم RdRp و پروتئين نوكلئوكپسيد است، مورد هدف قرار ميدهد. وقتي همسترهاي آلوده به SARS-CoV-2 فرمولاسيون استنشاقي اين دارو را دريافت كردند، تكثير ويروسي و علائم بيماري در آنها كاهش پيدا كرد.
سپتامبر ۲۰۲۰، متيو ديزني، شيميدان مؤسسه تحقيقات اسكريپس و همكارانش در مجلهي ACS Central Science گزارش كردند كه تركيبي به نام C5 را كشف كردهاند كه قطعهاي كوتاه و سنجاقسر مانندي از RNA را مهار ميكند كه در تكثير SARS-CoV-2 نقش دارد.
ازآنجاكه SARS-COV-2 براي تكثير به پروتئينهاي سلول ميزبان وابسته است، مختل كردن آن پروتئينها نيز ميتواند يكي ديگر از راههاي درمان باشد. مزيت اين رويكرد آن است كه وقتي ويروس مستقيما مورد هدف قرار نگيرد، احتمال ايجاد مقاومت دربرابر داروها كم ميشود. اين اهداف شامل پروتئازهاي TMPRSS2 و فورين است كه داروهاي كانديداي گروه نوانكو آنها را مهار ميكنند. ماه گذشته، مؤسسه ملي سلامت اعلام كرد كه درحال راهاندازي كارآزمايي مرحلهي دوم/سومي براي كاموستات مسيلات يكي ديگر از مهاركنندههاي TMPRSS2 است.
هدف ديگر پروتئيني به نام ديهيدرواوروتات دهيدروژناز (DHODH) است. اين پروتئين ركن اساسي مسيري است كه سلولها وقتي به RNA اضافي نياز دارند (مثلا هنگام تكثير)، از آن براي ساخت دو مورد از چهار باز RNA استفاده ميكنند. ويروسها براي تكثير خود اين مسير را ميربايند. در مطالعات سلولي، مهار ديهيدرواوروتات دهيدروژناز موجب توقف سرطان و بيماريهاي ويروسي مانند آنفلوانزا و سيتومگالوويروس شده است و ايمني بازدارندههاي DHODH با آزمايش روي هزاران بيمارن تأييد شده است.
دو شركت بيوتكنولوژي به نامهاي PTC Therapeutics و Immunic Therapeutics درحال آزمايش همين استراتژي دربرابر SARS-CoV-2 هستند. مارلا ويتال از شركت PTC Therapeutics ميگويد: «ويروسهايي كه سرعت تكثير بالايي دارند، به RNA بسيار نياز دارند». تركيب اين شركت كه PTC299 نام دارد، در اصل بهعنوان دارويي خوراكي براي توقف تكثير سلولها در لوسمي حاد ميلوئيدي طراحي شد.
ويتال و همكارانش در پيشچاپي در آگوست ۲۰۲۰ گزارش كردند كه PTC299 بهشدت تكثير ويروس SARS-CoV-2 را در سلولها مهار ميكند. اين تركيب همچنين توليد مولكولهاي ايمني را كه سلولها با استفاده از بازهاي RNA ميسازند، مهار ميكند. بنابراين، ممكن است به آرام كردن فعاليت بيشازحد سيستم ايمني كه در موارد شديد كوويد ۱۹ ديده شده است، نيز كمك كند.
دنيل ويت، مديرعامل شركت Immunic Therapeutics ميگويد شركت او همچنين نتايج اميدواركنندهاي در كارآزماييهاي انساني تركيب خوراكي IMU-838 كه براي درمان بيماريهاي التهابي و خودايمني ساخته شده است، ديده است. در ماه فوريه، شركت نتايج اوليهاي را گزارش كرد كه نشان ميداد بيماران بستريشده كه اين دارو را دريافت ميكردند، به تهويهي مصنوعي كمتر نياز داشتند.
درنهايت، احتمالا هيچيك از تركيبات نميتواند ويروس كرونا را به كلي حذف كند و يكي از دلايل آن، احتمال ظهور ويروسهاي مقاوم دربرابر دارو است. پژوهشگران استدلال ميكنند بهترين استراتژي، همان استراتژي است كه در درمان HIV و هپاتيت C نيز به كار گرفته ميشود يعني تركيب چندين داروي ضدويروس كه پروتئينهاي مختلفي را مورد هدف قرار ميدهند. در اين شرايط، احتمال تكامل همزمان ويروس در چند منطقه كم ميشود.
ليليان چيانگ، مديرعامل شركت Evrys Bio كه درحال كار روي ضدويروسهايي عليه پروتئينهاي سلول ميزبان است ميگويد: «واقعا به يك زرادخانه نياز داريم». مايكل سوفيا، مدير ارشد علمي شركت كانادايي Arbutus Biopharma، ميگويد: «اين كار زمان ميبرد». البته، به پول هم نياز است. براساس برآوردهاي اخير، رساندن داروي جديدي به بازار چيزي حدود ۹۸۵ ميليون تا ۲/۸ ميليارد دلار هزينه دارد.
اندرسون از شركت فايزر ميگويد شركت آنها بدون انتظار سود منابع شركت را در مبارزه با دنياگيري به كار ميگيرد. شركتهاي ديگر نيز همين را ميگويند. اما در جريان فروكش كردن شيوع بيماريهاي عفوني، بسياري از شركتهاي دارويي كار روي ضدويروسها را رها كردهاند. يكي از عوامل بازداندهي ديگر آن است كه درمانهاي ضدويروسي SARS-CoV-2 ممكن است فقط براي يكي دو هفته داده شود و سود چنداني به شركتهاي سازندهي دارو برنميگرداند. درنتيجه دنيسون و ديگران استدلال ميكند كه براي ادامهي كار روي ضدويروسها به حمايت دولت نياز است. بهگفتهي آنها، هر آرامشي در جنگ دربرابر SARS-CoV-2 و ويروسهاي مشابه آن احتمالا موقتي خواهد بود و در آينده ويروس كروناي ديگري خواهيم داشت.
هم انديشي ها