
بسياري از افراد به اشتباه تصور ميكنند كه سرطان يك بيماري است در حاليكه سرطان نوعي از بيماري است كه با تغيير در ساختار طبيعي يك سلول به وجود مي آيد. بدن انسان از متشكل از ميليونها سلول است كه باعث ايجاد بافتهايي مانند ماهيچهها، استخوان و پوست ميشود. سلولها بهطور منظم و كنترلشده تكثير ميشوند كه اين كار منجر به رشد و ترميم بافتهاي بدن ميشود. اما رشد غير عادي و بيش از حد سلولهاي غيرطبيعي، تومور ناميده ميشود كه ميتواند خوشخيم يا بدخيم باشد.
بهگفتهي سازمان بهداشت جهاني، حدود ۳۰ درصد تمام موارد سرطانها قابل پيشگيري هستند. برآورد شده است كه تنها ۵ الي ۱۰ درصد تمام سرطانها به نقص ژن ارثي مربوط هستند و بقيهي سرطانها به آلايندههاي زيستمحيطي، عفونتها و انتخاب شيوهي زندگي مانند، سيگار كشيدن، رژيم غذايي نامناسب و نداشتن فعاليت فيزيكي مربوط ميشود. بزرگترين عامل خطر ايجاد سرطان در سطح جهان كه قابل پيشگيري است سيگار كشيدن و استعمال تنباكو است. سلولهاي سرطاني، سلولهايي غيرطبيعي هستند كه به سرعت توليد مثل ميكنند و تواناييشان را براي كپي شدن و رشد، حفظ ميكنند. نتيجهي اين رشد بدون كنترل سلول، ايجاد تودههاي بافت يا تومور است.
تقريباً ۳۰ درصد سرطانها قابل پيشگيري هستند و بيش از ۱۰۰ نوع سرطان وجود دارد
تومورها همچنان به رشد ادامه ميدهند و برخي كه بهعنوان تومورهاي بدخيم شناخته شدهاند، ميتوانند از يك محل به محل ديگر منتشر شوند. سلولهاي سرطاني از جنبههايي با سلولهاي طبيعي متفاوت هستند. سلولهاي سرطاني، پيري بيولوژيكي را تجربه نميكنند، توانايي خود را براي تقسيم شدن حفظ ميكنند، و به سيگنالهاي پايان كار خود پاسخ نميدهند. آنچه كه ما بهعنوان سرطان ميشناسيم در واقع گروهي بيش از ۱۰۰ مدل بيماري مختلف است. نقطهي مشترك تمامي اين بيماريها، رشد بيرويه و غيرمعمول سلولهاي بدن است. اين رشد سبب از بين رفتن بافتهاي اطراف ميشود و حتي در حالتي وخيم، طي مرحلهي متاستاز، اين سلولها به ديگر بخشهاي بدن نيز سرايت ميكنند و رشد را در آن ناحيه ادامه ميدهند. در ادامه به انواع تومورهاي سرطاني ميپردازيم.
تومورهاي خوشخيم
اين دسته از تومورها آهسته رشد ميكنند و به بافتهاي ديگر تهاجم نميكنند يعني معمولا محدود به قسمت كوچكي از بدن هستند. بااينحال اين دسته از تومورها عمر افراد را كوتاه نميكنند با درمان به موقع قابل كنترل هستند كه تنها راه درمان تومورهاي خوشخيم جراحي است. البته دسته محدودي از تومورهاي خوشخيم ممكن است كشنده باشند؛ در صورتي كه در محلهاي خاصي به وجود بيايند و اختلال در يك اندام حياتي ايجاد كنند ممكن است منجر به مرگ فرد شوند. اما بااينحال اكثر تومورهاي خوشخيم منجر به مرگ نميشوند.
تومورهاي بدخيم
اما در نقطه مقابل تومورهاي خوشخيم، تومورهاي بدخيم هستند چراكه اين تومورها از ناحيه محدودي شروع به رشد ميكنند اما به سرعت به بافتها و ارگانهاي ديگر بدن تجاوز ميكنند. بخشهايي كه بهطور طبيعي عهدهدار دفاع از بدن هستند مانند سيستم ايمني بدن ممكن است قادر به پيشگيري از تقسيم بيرويه نباشند. تومورهاي سرطاني بدخيم ممكن است اتصال خود را با بافت تومورال از دست بدهند و ازطريق جريان خون يا توسط سيستم لنفاتيك به مناطق دورتري در بدن منتقل شوند و درآنجا رشد كنند و ارگان ديگري از بدن را به سرطان مبتلا كنند. اين عمل متاستاز نام دارد و زماني رخ ميدهد كه سرطان پيشرفت كرده باشد. يكي از ترسناكترين اتفاقات در مورد سرطان، پروسهي متاستاز است. طي اين مرحله، ميليونها سلول مبتلا از تومور جدا شده و وارد رگهاي خوني ميشوند. در اين مواقع درمان سرطان سختتر خواهد شد. تومورها از سه راه مختلف ميتوانند به ارگانهاي دوردست گسترش بيابند:
- ازطريق بافت: سرطان به بافت نرمال مجاور حمله ميكند.
- ازطريق دستگاه لنفاوي: سرطان به دستگاه لنفاوي حمله و در عروق لنفاوي حركت ميكند و به ديگر نقاط بدن ميرسد.
- ازطريق خون: سرطان به سياهرگها و مويرگها حمله ميكند و همراه خون به ديگر نقاط بدن ميرسد.
خوشبختانه، اكثر اين سلولها توسط سيستم ايمني بدن از بين ميروند اما تعداد اندكي كه قادر به فرار هستند، زنده ميمانند و ازطريق رگها وارد بافت ميشوند. درنتيجه سلولهاي عفوني ميتوانند در بخشي ديگر از بدن نيز به تخريب بپردازند. در واقع تفاوت اصلي بين اين دو تومور، عدم رخ دادن پروسهي متاستاز در تومورهاي خوشخيم است. تومور خوش خيم معمولا پس از يك بار معالجه ديگر باز نميگردد و ازطريق جراحي نسبت به حذف آن اقدام ميشود. اگر سرطان پستان به استخوانها گسترش يابد، سلولهاي سرطاني در استخوان در واقع سلولهاي سرطان پستان هستند، و بيماي سرطان متاستازي پستان است و سرطان استخوان نيست.
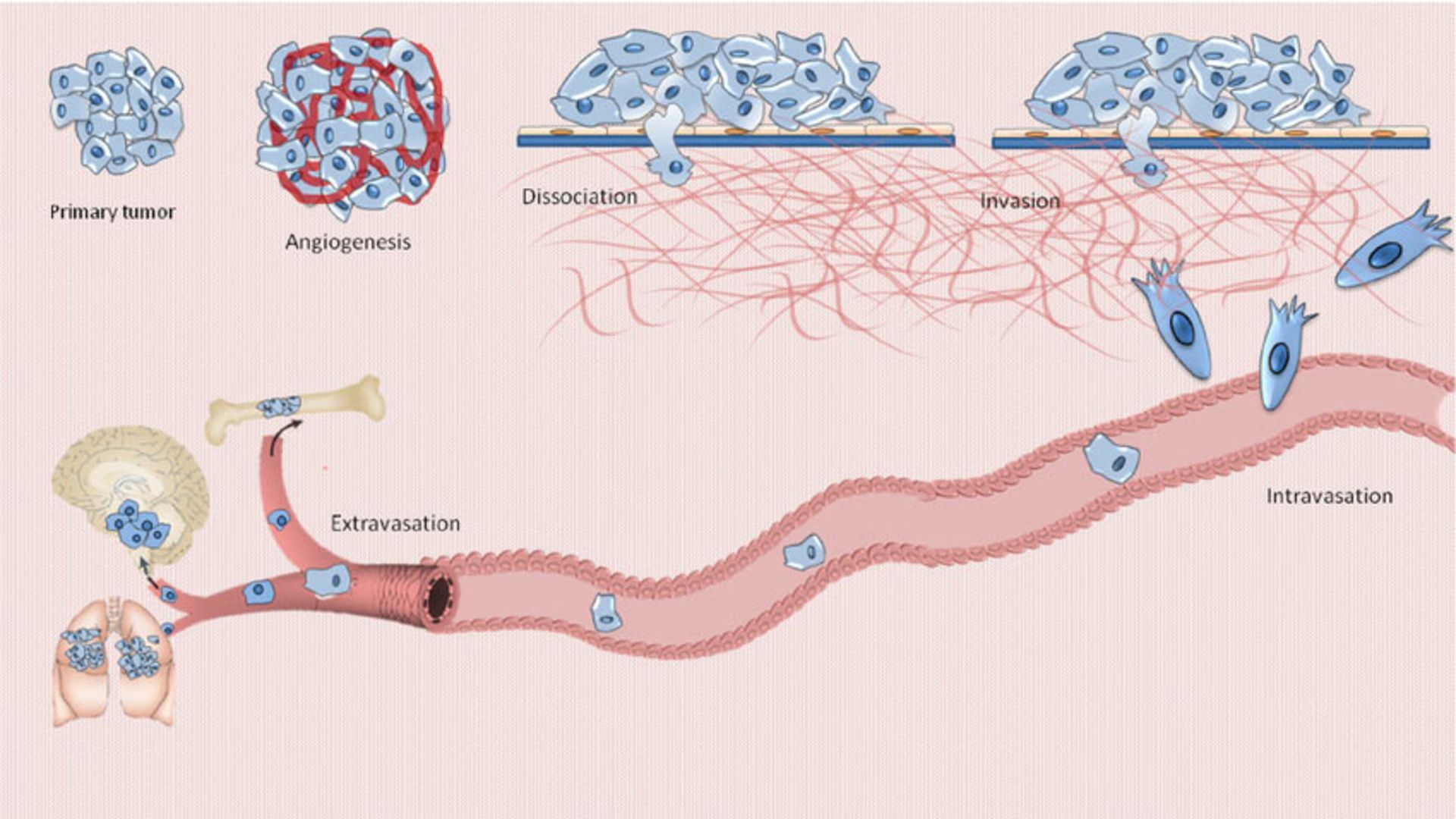
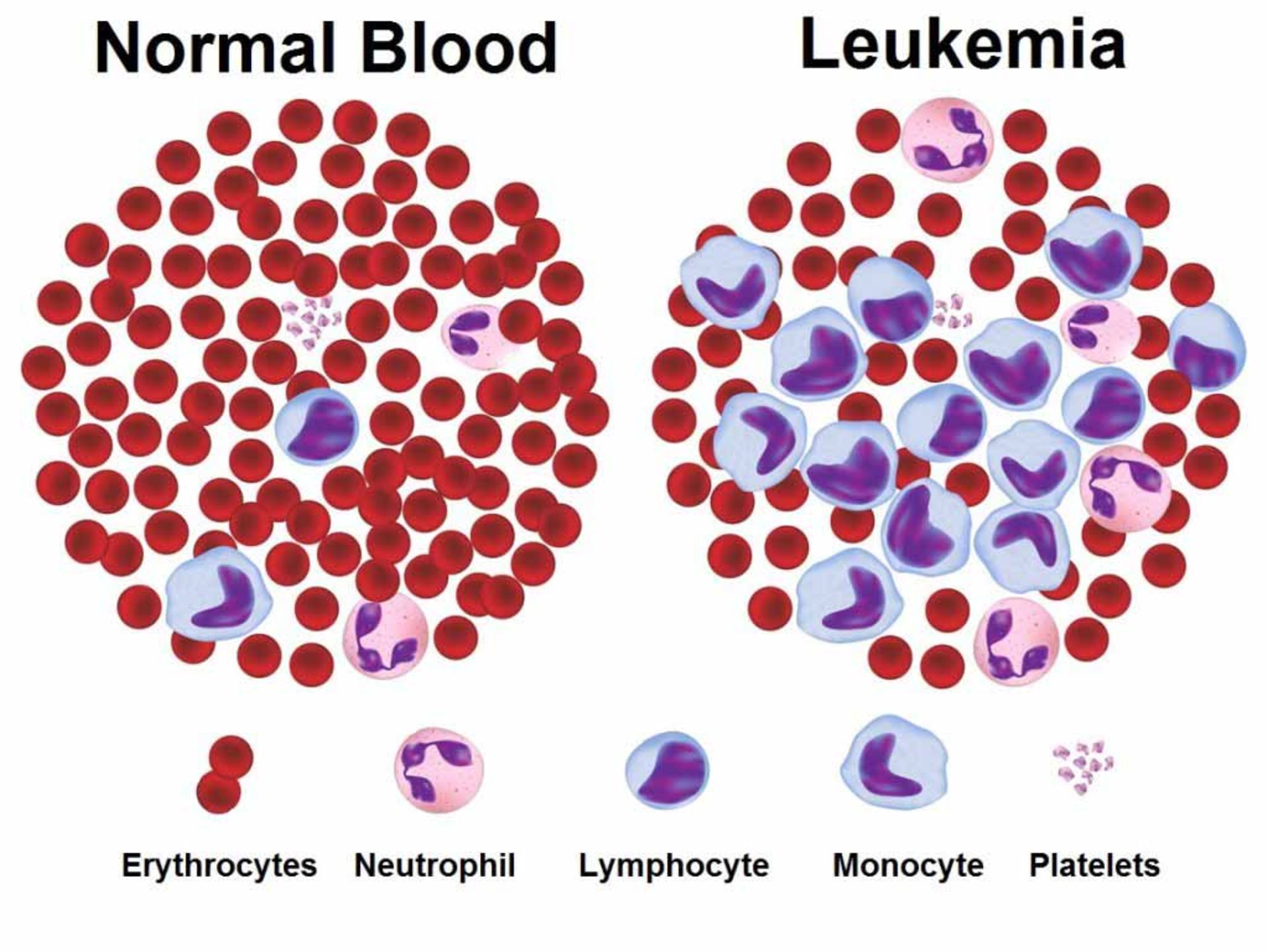
شكل بالا متاستاز را نشان ميدهد. متاستاز (Metastasis) به گسترش و مهاجرت سلولهاي سرطاني از يك بافت به بافتهاي ديگر، گفته ميشود. بسته به اينكه سلول سرطاني مربوط به كدام ارگان است، سرطان نامگذاري ميشود؛ بهعنوان مثال اگر كبد آلوده شود سرطان كبد نام دارد و اگر سلول ريوي باشد، سرطان ريه، اگر سلول خون باشد، سرطان خون و غيره. سرطانهاي بدخيم به دو دستهي ساركومها و كارسينومها تقسيم ميشوند. انواع مختلفي از سرطانها وجود دارند و اين سرطانها ممكن است در هر نوع سلول بدن ايجاد شوند. انواع سرطانها معمولا به نام اندام، بافت يا سلولهايي كه در آنها به وجود ميآيند، نامگذاري ميشوند. رايجترين نوع سرطان، سرطان پوست است. سرطان پوست در بافت اپيتليال، كه خارج بدن، خطوط اندام، رگها و حفرهها را ميپوشاند، ايجاد ميشود. ساركوم نوعي از سرطان است كه در عضله، استخوان و بافت نرم همبند از جمله چربي، عروق خوني، عروق لنفاوي، تاندونها و رباطها تشكيل ميشود. لوسمي، سرطاني است كه از سلولهاي مغز استخوان كه سلولهاي سفيد خون را تشكيل ميدهند، سرچشمه ميگيرد.
لنفوم در سلولهاي سفيد خون بنام لنفوسيتها ايجاد ميشود. اين نوع سرطان بر سلولهاي B و سلولهاي T تأثير ميگذارد. سلولهاي سرطاني نسبت به سلولهاي طبيعي، از گلوكز خيلي بيشتري براي رشدشان استفاده ميكنند. گلوكز يك قند ساده است كه براي توليد انرژي، طريق تنفس سلولي مورد نياز است. سلولهاي سرطاني با سرعت بالا از قند استفاده ميكنند تا به تقسيم ادامه دهند. اين سلولها انرژي خود را تنها ازطريق گليكوليز به دست نميآورند. گليكوليز روند قطعهقطعه شدن قند براي توليد انرژي است. ميتوكندري سلولهاي تومور، انرژي مورد نياز براي به وجود آمدن رشد غيرطبيعي مرتبط با سلولهاي سرطاني را تأمين ميكند. ميتوكندري يك منبع انرژي تقويتشده ايجاد ميكند كه همچنين باعث ميشود سلولهاي تومور به شيميدرماني مقاومتر شوند.
سلولهاي سرطاني از گلوكز زيادي نسبت به ديگر سلولها براي رشدشان استفاده ميكنند
همهي ما از لقاح يك اسپرم و يك تخمك بهوجود آمدهايم. چند روز بعد از لقاح و وقتي تخمك بارور ميشود، بر اثر فرايند تقسيم سلولي توپي متشكل از چند صد سلول بهوجود ميآيد؛ بدن ما از همين تقسيمهاي سلولي ساخته ميشود. زماني كه به بلوغ كامل ميرسيم، بدن ما تريليونها سلول دارد. تقسيم سلولي در بدن ما به صورت كاملاً كنترلشده انجام ميشود حتي بعضي از سلولها عامدانه از بين ميروند تا بدن ما صحيح شكل بگيرد. مثلا زماني كه در دوران جنيني دستهاي ما بهوجود آمد، بعضي از سلولها در فرايندي به نام خزان ياختهاي يا آپوپتوزيس خودكشي كردند تا فضاي بين انگشتها ساخته شود. اين تقسيم سلولي براي رشد و نمو ما ضروري است، بااينحال اگر تقسيمها از كنترل خارج شوند آن زمان است كه اشكال ايجاد ميشود. سلولهاي سرطاني ميتوانند با پنهان كردن خود در ميان سلولهاي سالم از سيستم ايمني بدن اجتناب كنند.
بهعنوان مثال، برخي از تومورها پروتئيني ترشح ميكنند كه به وسيله غدد لنفاوي هم ترشح ميشوند. اين پروتئين به تومور اجازه ميدهد تا لايهي بيرونياش را به چيزي كه شبيه بافتهاي لنفاوي است تغيير شكل دهد. اين تومورها به صورت بافت سالم و نه بافت سرطاني به انديشه متخصصين ميرسند. درنتيجه، سلولهاي ايمني تومور را بهعنوان يك مادهي مضر تشخيص نميدهند و تومور اجازه مييابد رشد كند و به شكل بيرويه در بدن گسترش يابد. سلولهاي سرطاني ديگر با مخفي شدن در محفظههايي در بدن از داروهاي شيميدرماني دوري ميكنند. برخي از سلولهاي لوسمي با پناه گرفتن در محفظههايي در استخوانها از درمان دوري ميكنند. سرطان همان از دست رفتن كنترل سلولهاست. اگر بعضي از ژنهاي كنترلكنندهي تقسيم سلولها مثل ژن p53 در سلولي دچار جهش شود، آن سلول سرطاني ميشود و به صورت كنترلنشده شروع به تقسيم شدن ميكند.
البته بدن ما براي يافتن اين جهشها ابزارهايي دارد. بعضي مكانيسمهاي بيولوژيكي در بدن ما وجود دارد كه ميتواند بيشتر سلولهاي جهشيافته را قبل از اينكه اشكالي براي ما بهوجود آورند، نابود كند. بهگفتهي چارلز سوانتون از انستيتوي فرانسيس كريك در انگلستان، در پس اين فرايند، ميليونها سال تكامل قرار دارد. اين مكانيسم خيلي خوب عمل ميكند ولي بينقص هم نيست. تهديد از جانب تعداد كمي از سلولها است كه مكانيسم ترميمي نميتواند آنها را درست كند. در طول زمان يكي از اين سلولهاي افسار گسيخته ميتواند آنقدر تقسيم شود كه در نهايت غدهاي متشكل از هزاران سلول را تشكيل دهد. در آخر وقتي تعداد آنها به ميلياردها رسيد با يك تومور مواجه ميشويم. وقتي انباشت سلولها تبديل به تومور شد، فرد بهطور كامل به سرطان مبتلا شده است.
تومور بايد خارج و همهي سلولهاي سرطاني در آورده شوند. حتي اگر چند سلول باقي بماند، خيلي سريع ممكن است دوباره تقسيم شوند و تومورهاي جديد بهوجود آورند. سلولهاي سرطاني دستخوش تغييراتي ميشوند تا از دفاعهاي سيستم ايمني اجتناب كنند، همچنين دربرابر اشعه و درمان شيميدرماني از خود نگهباني كنند. براي مثال سلولهاي اپيتليال سرطاني، از شبيه شدن به سلولهاي سالم با اشكال تعريف شده، به سمت شبيه شدن به بافت همبند سست ميروند. توانايي تغيير شكل به غير فعال شدن سوئيچهاي مولكولياي به نام ميكرو RNAها نسبت داده ميشود. اين مولكولهاي RNA تنظيمي كوچك، توانايي تنظيم نحوهي بيان ژن را دارند. هنگامي كه ميكرو RNAهاي خاص غيرفعال ميشوند، سلولهاي سرطاني توانايي براي تغيير شكل را به دست ميآورند. يكي از نشانههاي واضح سرطان افزايش سريع تشكيل عروق خوني جديد است كه بهعنوان رگزايي شناخته ميشود. تومورها براي رشد به مواد مغذياي كه به وسيلهي رگهاي خوني ارايه ميشوند، نياز دارند.
تومورها دائما از لحاظ ژنتيكي تغيير ميكنند و به اين دليل درمان سرطان، سختتر ميشود
اندوتليوم عروق خوني هم مسئول رگزايي نرمال و هم رگزايي تومور است. سلولهاي سرطاني سيگنالهايي به سلولهاي سالم اطراف ميفرستند و آنها را تحت تأثير قرار ميدهند تا عروق خوني جديدي ايجاد كنند و سلولهاي سرطاني را تأمين كنند. پژوهشها نشان دادهاند كه وقتي از تشكيل عروق خوني جديد ممانعت ميشود، رشد تومورها متوقف ميشود. همهي سلولهاي سرطاني شبيه به هم نيستند. وقتي يك سلول سرطاني تقسيم ميشود، ممكن است دچار جهشهاي ژنتيكي جديد شود كه رفتار آن را تغيير ميدهد. به بيان ديگر، سلول سرطاني تكامل پيدا ميكند. وقتي كه سلولهاي درون يك تومور جهش پيدا ميكنند، از انديشه متخصصين ژنتيكي بسيار گوناگون ميشوند. سلولهاي سرطاني هم درست مثل انسانها، شيرها، قورباغهها و باكتريها در طول زمان دچار تنوع ژنتيكي ميشوند. نميتوانيد در يك تومور، دو سلول شبيه به هم پيدا كنيد در يك تومور سلولهايي باقي ميمانند كه سرطانيتر هستند. ما با شاخههايي از تكامل دستوپنجه نرم ميكنيم كه تنوع را ميسازند و تنوع باعث ميشود تومور دربرابر درمان مقاومت كند.
در حقيقت از دلايلي كه باعث ميشود سرطان را بتوان سخت درمان كرد اين است كه تومورها دائما از انديشه متخصصين ژنتيكي تغيير ميكنند. بههميندليل، دانشمندان ميخواهند از در تكامل براي درمان سرطان وارد شوند. به تكاملي كه در يك تومور سرطاني رخ ميدهد به شكل درختي با شاخههاي زياد نگاه كنيد. در پايهي درخت جهشهاي ژنتيكي اوليهاي قرار دارند كه باعث فعال شدن تومور شدهاند؛ جهشهايي كه بين همهي سلولهاي تومور به اشتراك گذاشته ميشوند و همهي آنها داراي آن جهش ژنتيكي هستند. به صورت انديشه متخصصيني، درماني كه بتواند آن جهشهاي اوليه را هدف بگيرد بايد همهي سلولهاي تومور را نابود كند. اين روشي است كه اكنون در بعضي درمانها استفاده ميشود. اشكال اينجاست كه اين درمانها آنقدر كه اميد داريم خوب كار نميكنند و معمولا تومور دربرابر آنها مقاومت ميكند.
علايم سرطان
- تورم گردن و صورت: سرطان ريه مي تواند باعث تورم در ناحيه صورت، گردن، بازوها و قسمت بالايي سينه شود و اين زماني است كه يك تومور به رگي كه از سر به قلب ميرود فشار وارد ميكند.
- ضعف عضلات: اگر انجام كارها مانند بلند كردن يك جزوه رايگان بزرگ يا بيرون آمدن از تخت خواب بهطورروزانه براي شما سخت است، اين علامت ميتواند نشانهي بيماري سرطان باشد.
- كاهش اشتها: از دست دادن اشتها يكي ديگر از نشانههايي است كه ميتوان بهراحتي آن را با اشكالات بيخطر مرتبط دانست؛ بااينحال اگر اين وضعيت براي مدت طولاني ادامه پيدا كند يا با ساير نشانهها مانند نفخ همراه شود، به معاينهي فوري نياز دارد.
- تغييرات پوست: وقتي متوجه تغيير در اندازه، شكل، رنگ يك خال يا لكههاي ديگري روي پوست خود شديد، هرچه سريعتر به پزشك خود مراجعه كنيد. لكههاي جديد يا آنهايي كه متفاوت به انديشه متخصصين ميرسند، مهمترين علايم سرطان پوست بهحساب ميآيند.
- خونريزي غيرطبيعي: اگر دچار خونريزي غيرطبيعي در هر جاي بدنتان از جمله دهان، انتهاي روده، واژن يا مجراي ادرار شدهايد، فورا به پزشك مراجعه كنيد. اگر بعد از عمل سزارين يا بين دو دورهي قاعدگي متوجهي خونريزي شديد، احتمال سرطان رحم وجود دارد.مقالهي مرتبط:معرفي روش درمان جديد براي سرطان سينه تهاجمي
- كاهش وزن ناگهاني: كاهش وزن ناگهاني ميتواند از نشانههاي سرطان معده باشد كه البته تشخيص اين نوع از سرطان در مراحل اوليهي ابتلا به آن بسيار دشوار است. گاهي سلولهاي سرطاني از بافت اوليهاي كه در آن ايجاد شدهاند جدا ميشوند و از راه جريان خون يا سيستم لنفاوي خود را به ديگر اعضاي بدن ميرسانند و در محل جديدي تكثير ميشوند و كانون سرطاني جديدي ميسازند.
- خستگي: ضعف و خستگي كه با استراحت يا خواب كاهش نمييابد، بايد توسط پزشك مطالعه شود و ممكن است نشانهاي از سرطان باشد كه البته پزشك بايد با توجه به نشانههاي ديگر آن را مطالعه كند.
- سرفههاي شديد: سرفههاي طولاني ميتواند خطر جدي براي سلامت شما باشد. سرفه معمولا ميتواند به اين معنا باشد كه در دستگاه تنفسي شما اشكالي وجود دارد اما اگر صدايتان ناهنجار و خشن شود يا همراه با سرفه خون ببينيد، داستان متفاوت است.
- وجود توده: بدن خود را لمس كنيد و اگر در جايي تودهاي حس كرديد، هرچهقدر هم كه كوچك باشد، براي مطالعه آن به پزشك مراجعه كنيد. هر تودهاي كه در حال تغيير است بايد توسط پزشك مطالعه شود. تودهها در پستان و البته بيضه بهترتيب علائم بسيار شايع سرطان پستان و پروستات هستند.
- نفخ: نفخ بيدليل و طولاني مدت ميتواند يكي از نشانههاي سرطان تخمدان باشد. نفخ شكم همراه با درد لگن، ورم رودهها و احساس پر بودن شكم نيز ممكن است از ديگر نشانهها باشد. همچنين درد يا نفخ معده پس از خوردن ممكن است نشانهي سرطان معده باشد.
عوامل ايجاد سرطان

پارازيتها
پارازيت، موج الكترومغناطيسي از نوع مايكروويو است كه از جنس همان امواج ماهواره است ولي قويتر از آن. چرا دربارهي پارازيتهاي ماهوارهاي سالهاي اخير نگرانين هستيم؟ تفاوت اين امواج با ساير امواج چيست؟ تفاوت امواج الكترومغناطيس به ميزان طول موج، فركانس و قدرت انرژي آنها است. طول موج امواج مايكروويو از امواج راديويي كمتر است، در عوض فركانس و انرژي آنها بيشتر است. پژوهشها و انديشه متخصصينهاي زيادي دربارهي تأثير منفي امواج مايكروويو، تلفن همراه و حتي اجاقهاي مايكروويو بر سلامت وجود دارد، اما تأثير امواج پارازيت چطور؟
مواد آرسنيكدار
تصور عام بر اين است كه تنها نور آفتاب براي پوست افراد مضر است و سرطانزا است در حاليكه مواد آرسنيكدار نيز اين قابليت را دارند. موادي كه در آن تركيبات آرسنيكدار وجود داشته باشد در صورت تماس با پوست ميتوانند منجر به سرطانهاي پوستي شوند. شايد جالب باشد بدانيد آرسنيك در جنگ جهاني دوم براي درمان سرطان استفاده ميشده است. اين ماده در آب، خاك و بستر سنگها يافت ميشود و در صنعت نيز براي ساخت چوب حشرهكش، شيشه، آلياژها به متخصصد ميرود. آرسنيك در آب آشاميدني هم وجود دارد كه ميزان استاندارد آن ۵۰ در يك بيليونيوم است. آرسنيك شبهفلز خاكستري نقرهاي رنگي است كه به صورت معدني و در آب وجود دارد. متخصصان آنكولوژي معتقد هستند در مناطقي كه فرسايش خاك بسيار است ميزان آرسنيك موجود در هوا زيادتر از حد معمول است و بدين ترتيب مردم اين مناطق بيشتر درمعرض ابتلا به سرطانهاي پوست، ريه، مجاي ادراري، سرطان كليه قرا دارند. همچنين گزارش شده است كه برخي برنجهاي وارداتي و همچنين برنجهاي داخلي آلوده به آرسنيك هستند.
آلايندههاي هوا
ساركوم نوعي از سرطان است كه در عضله، استخوان و بافت نرم همبند تشكيل ميشود
از ديگر عوامل محيطي ميتوان به اشعههاي موجود در محيط و تركيبات يونيزه اشاره كرد، هرچند كه اينها به صورت ناخواسته در هوا پراكنده هستند اما بسيار مخرب محسوب ميشوند. گزارشها اخير حاكي از آن است كه گردوغبارهاي حاصل از اقدامات صنعتي علاوه بر اينكه باعث بروز بيماريهاي قلبي عروقي ميشوند ميتوانند سرطان مجاري تنفسي را به همراه داشته باشند. آژانس حفاظت از محيط زيست آمريكا (EPA)، طي گزارشي در سال ۲۰۰۹ منتشر كرد كه نقطهي عطفي در خصوص برآورد غلظت آلايندههاي هوا به شمار ميآمد. در اين گزارش بيش از ۱۸۱ آلايندهي مختلف موجود در هوا مورد مطالعه قرار گرفتند كه از اين ميان ۸۰ آلاينده به شكلگيري سرطان در انسان كمك ميكنند. بهعنوان مثال تنفس بنزن آزاد شده از اگزوز اتومبيلها ميتواند منجر به سرطان شود در واقع حدود ۳۰ درصد از سرطانهاي ناشي از هواي آلوده به دليل دود ماشينها هستند، ۲۵ درصد ديگر از سرطانها به دليل آلودگيهاي صنعتي و كارخانهاي است.
مكملها و مولتيويتامينها
فقط افراد مبتلا به كمبود ويتامين و مواد معدني و زنان باردار مجاز به استفاده از مكملها هستند. در سال ۲۰۱۰ آژانس تحقيقات سلامت ايالات متحده با مطالعه ۶۳ پژوهش گسترده به اين نتيجه رسيد كه استفاده از مولتيويتامينها هيچ تأثيري در پيشگيري از ابتلا به سرطان و بيماري قلبي در بين اكثر مردم جهان ندارند. در عوض استفاده از بعضي از مكملها مانند ويتامين E، بتاكاروتين و ويتامين C ميتوانند به سلامت بدن آسيب وارد كنند و خطر ابتلا به بيماري را افزايش دهند.
بسياري از مردم معتقدند آنتياكسيدانهايي مانند ويتامين E ميتوانند با راديكالهاي آزاد و مضر بدن كه بر اثر عواملي مانند سيگار كشيدن، نور آفتاب و مصرف غذاهاي چرب بهوجود ميآيند، مبارزه كنند. حقيقت اين است كه از بين بردن كامل اين راديكالهاي آزاد كار درستي نيست. بدن در بعضي موارد اين راديكالهاي آزاد را توليد ميكند تا با سلولهاي مضر از جمله سلولهاي سرطاني مبارزه كند. اگر شما با مصرف دائمي ويتامينها اين مكانيسم را متوقف كنيد، بدن توانايي طبيعي كنترل خود را از دست ميدهد. بنابراين بهتر است به جاي آنكه پول خود را صرف خريد مكملهاي گرانارزش كنيد، غذاهاي سالم و باكيفيت بهتر تهيه كنيد.
غذاهاي كنسروي
تقريباً بيشتر غذاهاي كنسروي را ميتوان جزو موادغذايي ناسالم محسوب كرد چون در ساخت قوطي كنسرو از يك مادهي شيميايي به نام بيسفنول-A يا BPA استفاده ميكنند. در همين زمينه پژوهشهايي توسط آكادمي ملي علوم آمريكا در سال ۲۰۱۳ انجام شد و نتايج آن به اين صورت بود كه BPA حتي روي ژنهايي كه داخل مغز موشهاي فاضلابي كار ميكنند نيز تأثير مخرب ميگذارد. حتي سازمان غذا و داروي آمريكا چنان تحت تأثير BPA قرار گرفته است كه خواستار جايگزين كردن قوطيهاي كنسرو يا حداقل كاهش دادن توليدهاي كنسروي شده است. خود گوجهفرنگي به خاطر خاصيت بالاي اسيدياش، كار را خطرناكتر هم ميكند. اين خاصيت اسيدي باعث ميشود تا BPA موجود در جدارهي داخلي قوطي كنسرو راحتتر متساعد شود و به داخل گوجهها برود. براساس قوانين سازمان غذا و داروي آمريكا هيچ برچسبي تعريف نشده وجود ندارد كه نشان دهد اين قوطيها داراي BPA هستند.
ميوهها و سبزيجات غيرارگانيك
طي مرحلهي متاستاز، سلولهاي سرطاني به ديگر بخشهاي بدن نيز سرايت ميكنند
ميوهها و سبزيجات غيرارگانيك آلوده به سمومي مانند آترازين، تيوديكارب و ارگانوفسفات هستند تا از دست آفتها در امان بمانند. همچنين اين نوع ميوه و سبزيها را تا حد زيادي به كود نيتروژن آغشته كردهاند. آترازين مادهاي است كه دراروپا بهكارگيري آنرا ممنوع كردهاند زيرا براي تواناييهاي توليد مثلي انسان مضر است. در سال ۲۰۰۹، نتايج تحقيقات نشان داد كه اگر زن حاملهاي يك ليوان آب آلوده به آترازين بنوشد، از وزن بچهاش در هنگام تولد كم خواهد شد. گفته ميشود سبزيهايي كه از ورامين به تهران ميآورند با فاضلاب آبياري ميشوند كه در دراز مدت باعث بروز سرطان دستگاه گوارش ميشود. بااينحال، سونامي سرطاني كه متخصص كارشناسان ايراني از چند سال قبل پيشبيني كردهاند، چندان هم دور از ذهن نيست.
شكر تصفيهشده
شكر تصفيه شده ميتواند يكي ديگر از مواد سرطانزا به شمار رود. هر مادهاي روي آن عمليات پالايشي صورت گرفته باشد معمولا اثرات طبيعي خودش را از دست ميدهد و باعث اشكالات بعدي در بدن ميشود. علاوهبراين اشكال نبايد از شكر بهعنوان يك افزودني هميشگي استفاده كنيد، شكر بهعنوان قند وارد بدن شما ميشود و براي كساني كه اشكالات انسوليني دارند، يك خطر بزرگ محسوب ميشود و از طرفي اين ماده يكي از منابع تغذيهي سلولهاي سرطاني است. سودا هم بهعنوان يكي از فراوردههاي لاكتوزي در نوشابهها معمولا استفاده ميشود كه خود سرطانزا محسوب ميشود. اسيد موجود در نوشابهها هم سرطانزا است. بنابراين براي كنترل احتمال سرطان در بدن خودتان بايد مصرف قند و شكر خودتان را كنترل كنيد و از موادي كه قند طبيعي در خودشان دارند استفاده كنيد؛ هرچقدر از انواع شكرها دور بمانيد بهتر است.
گوشتهاي فرآوريشده

گوشتهاي فرآوريشده به آن دسته از فرآوردههاي گوشتي گفته ميشود كه از طرق مختلف مانند دودي يا نمك سود كردن يا افزودن مواد نگهدارنده مدت مصرف آنها افزايش مييابد يا مزه آنها تغيير ميكند. سازمان جهاني بهداشت ميگويد كه مصرف گوشتهاي فرآوريشده مانند بيكن، سوسيس، كالباس و ژامبون، باعث بروز سرطان ميشود. در گزارشي كه اين سازمان منتشر كرده، آمده است كه مصرف ۵۰ گرم گوشت فرآوريشده در روز ميتواند خطر ابتلا به سرطان روده بزرگ را تا ۱۸ درصد افزايش دهد. ميزان فراوان نمك و مواد شيميايياي كه در راستاي توليد كردن گوشت فرآوريشده به آن افزوده ميشود، براي سلامتي انسان مضر است. نتايج پژوهشهايي كه آنها انجام دادهاند نشان ميدهد كه بهطور ميانگين از هر ۱۷ نفري كه در اين تحقيق شركت كرده بود ۱ نفرشان مرد و آنهايي كه روزي ۱۶۰ گرم از اين سوسيس كالباسها خوردند، تا ۱۲ سال آينده، احتمال مرگشان ۴۴ درصد بيشتر از كساني است كه روزي ۲۰ گرم يا كمتر گوشت فرآوريشده خورده بودند. اين پژوهش با شركت افرادي از ۱۰ كشور اروپايي، در يك بازهي زماني ۱۳ ساله انجام شد.
مواد غذايي شور يا دودي
مواد غذايي كه با استفاده از نيتراتها يا واكنشهاي نيتراتي شور شدهاند. نه اينكه نيترات به خودي خود عامل سرطانزا باشد، اما تحت شرايط خاص، وقتي اين مواد شيميايي وارد بدن ميشوند به كامپوزيتهاي N-nitroso تبديل ميشوند. اين كامپوزيتهاي N-nitroso سرطانزا هستند. دودي كردن غذاها مثل ماهي دودي يا گوشت دودي، باعث ميشود تا اين غذاها مقادير زيادي قطران، همان سمي كه در سيگار موجود است، جذب كنند. قطران بهعنوان مادهاي سرطانزا شناخته ميشود. شواهد نشان ميدهد كه مصرف اين نوع غذاها بهشدت احتمال ابتلا به سرطان رودهي بزرگ و همينطور سرطان شكم را بالا ميبرند. در كشورهايي مثل ژاپن كه مردم به صورت سنتي غذاهاي شور زياد مصرف ميكنند آمار سرطان شكم خيلي بالا است.
نشستن طولانيمدت
شايد عجيب به انديشه متخصصين برسد، اما علت ابتلاي درصد زيادي از افراد به بيماري سرطان، نشستن طولانيمدت بوده است. نشستن طولاني مدت ميزان تريگليسريد، كلسترول، فشار و قند خون را افزايش ميدهد و ترشح هورمون اشتها را بيشتر ميكند. پژوهشهاي انجامشده توسط جامعهي سرطان ايالاتمتحده در سال ۲۰۱۰ نشان داد، نشستن بيش از ۶ ساعت در روز درست به اندازهي سيگار كشيدن و حتي بيشتر از آن ميتواند به سلامت انسانها آسيب وارد كند. البته زنان بيشتر از مردان بر اثر نشستنهاي طولانيمدت آسيب ميبينند كه دليل احتمالي آن هم فعاليت هورمونهاي زنانه مانند استروژن است. براي مثال زناني كه عادت به نشستن طولانيمدت دارند با احتمال ۳۷ درصد بيشتر از زناني كه كمتر از ۳ ساعت در روز مينشينند، ممكن است ظرف ۱۳ سال آينده به سرطان دچار شوند. اين آمار براي مردان حدود ۱۸ درصد است كه نشان ميدهد ميزان خطر براي آنها كمتر است.
كامپوزيتهاي N-nitroso كه از نيترات به وجود ميآيند، سرطانزا هستند
آبيموههاي صنعتي
قبلا تصور ميشد نوشيدن يك ليوان آبميوه بهترين روش براي شروع روز است. اما دانشمندان معتقدند مصرف بعضي از آبميوهها نهتنها مفيد نيستند، بلكه خطر مبتلا شدن به سرطان را هم افزايش ميدهند. آبميوههاي صنعتي به قدري شكر دارند كه بدن را براي جذب و حتي دفع اين مقدار با اشكال مواجه ميكنند. در حقيقت طي روند توليد و بستهبندي آبميوهها، بخش زيادي از تركيبات ضدسرطان آنها از بين ميرود. دانشمندان استراليايي تصميم گرفتند تأثير مصرف ميوهها، سبزيجات و انواع مختلفي از آبميوهها را در پيشگيري از سرطان مطالعه كنند. بعد از انجام پژوهشها روي ۲ هزار و ۲۰۰ نفر، آنها متوجه شدند خوردن ميوههايي مانند سيب و گلابي و سبزيجاتي مانند كلم بروكلي و گلكلم احتمال ابتلا به سرطان را كاهش ميدهد اما در عوض نوشيدن آبميوههاي صنعتي اين احتمال را افزايش ميدهد.
اين پژوهشها همچنين نشان داد افرادي كه بيش از سه ليوان در روز از اين آبميوهها مصرف ميكنند با احتمال بيشتري به يكي از انواع سرطانهاي روده دچار ميشوند. در هنگام توليد آبميوههاي صنعتي بخش مهمي از مواد ضدسرطان مانند فيبر، ويتامين C و مواد شيميايي موسوم به آنتياكسيدانها از بين ميروند. در عوض شكر زيادي در اين نوع آبميوهها مصرف ميشود كه ممكن است به رشد تومورهاي سرطاني كمك كند. البته آبميوههاي كاملاً طبيعي هم شكر زيادي دارند، اما به دليل داشتن مواد ضدسرطان استفاده از آنها به انواع صنعتي و ديگر نوشابهها ارجحيت دارد.
برخي ويروسها
سلولهاي سرطاني ممكن است درنتيجه برخي از عوامل از جمله قرار گرفتن درمعرض مواد شيميايي، اشعه، نور ماوراي بنفش و خطا در تكرار كرومواخبار تخصصي ها ايجاد شود. علاوه بر اين، ويروسها اين توانايي را هم دارند كه با تغيير ژنها باعث سرطان شوند. اين ويروسها با يكپارچهسازي مواد ژنتيكي خود با DNA سلول ميزبان، سلولها را تغيير ميدهند. ژنهاي ويروسي رشد سلول را تنظيم ميكنند و به سلول توانايي انجام رشد غيرطبيعي را ميدهند. ويروس پاپيلوماي انساني (HPV) كه باعث ايجاد زگيل در نواحي تناسلي ميشود، مسبب سرطان دهانه رحم است و ويروس Epstein-Barr كه عفونت مونونوكلئوز را ايجاد ميكند، عامل سرطان لنفوم بوركيت است.
اساس سلوليمولكولي سرطان
در سال ۲۰۰۳ توسط پروژهي ژنوم انسان، تمام ژنهاي انسان توالييابي شدند كه براي اولين بار مشخص شد فقط ۲۳۵۰۰ ژن فعال در هستهي هر سلول سوماتيك وجود دارد. اين ژنهاي فعال در حدود ۴۰۰ هزار نوع پروتئين را براي بدن ميسازند كه بهصورت پروتئين، آنزيم، هورمون، سيتوكين و مولكولهاي گيرنده در بدن وجود دارند. اين تنوعهاي مولكولي باعث تغييرات در ظاهر و داخل بدن انسان ميشود. سرطان يك بيماري ژنتيكي است كه ۲۷۷ نوع بيماري را شامل ميشود. همچنين در محيط زيستي ما بيش از يك صد هزار نوع مواد شيميايي وجود دارد كه فقط ۳۵ هزار از آن مطالعه شده است و حدود ۳۰۰ عدد از آنها توليد سرطان ميكنند. هنوز ۶۵ هزار مواد شيميايي باقيمانده در طبيعت آزمايش نشده است.
سرطان روابط و نظم بين سلولي را مختل ميكند و باعث نافرماني ژنهاي حياتي ميشود
۹۳ درصد سرطانها زاييدهي محيط زيست، ۳۰ درصد از دود سيگار، ۳۵ درصد از رژيم غذايي، ۲۵ درصد از بيماريهاي عفونتي و ۱۰ درصد از اشعههاي يوني و غيريوني است. سرطانها توسط يك سري جهشهاي متوالي در ژنهاي انسان اتفاق ميافتد و هر موتاسيون هم تا حدي تغييرات جديدي را در سلول بهوجود ميآورد. مواد شيميايي باعث ايجاد سلولهاي سرطاني به نام كارسينوژن ميشوند. دود سيگار در حدود ۴۰ مادهي شيميايي كارسينوژنيك دارد كه اغلب توليد سرطان شش ميكنند. در طبيعت بيش از ۱۰۰ هزار نوع مواد شيميايي وجود دارد كه بهطور مستقيم يا غيرمستقيم اثرات و صدمات خود را در ستيوپلاسم و هستهي سلولها وارد ميكنند و منجر به اختلالات ژنتيكي ميشوند و سرانجام جهشها را بهوجود ميآورند.
ويروسها، باكتريها و اشعههاي مختلف هم باعث ايجاد سرطانهاي وراثتي ميشوند كه تعداد آنها در حدود ۷ درصد كل سرطانها است. بافتهاي سرطاني به ۶ گروه تقسيم ميشوند: خون، غدد لنفاوي، ساركوما، كارسينوما، سلولهاي جنيني، سلولهاي جنسي. سرطان يك بيماري است كه روابط و نظم بين سلولي را مختل ميكند و باعث نافرماني ژنهاي حياتي و كليدي ميشود. اين بينظميهاي مولكولي در سيكل تقسيم سلولي اثر دارد و منجر به عدم تمايز سلولي ميشود. ژنهاي كليدي كه معيوب ميشوند و عملكرد آنها تغيير ميكنند به چهار گروه تقسيم ميشوند:
۱. انكوژنها
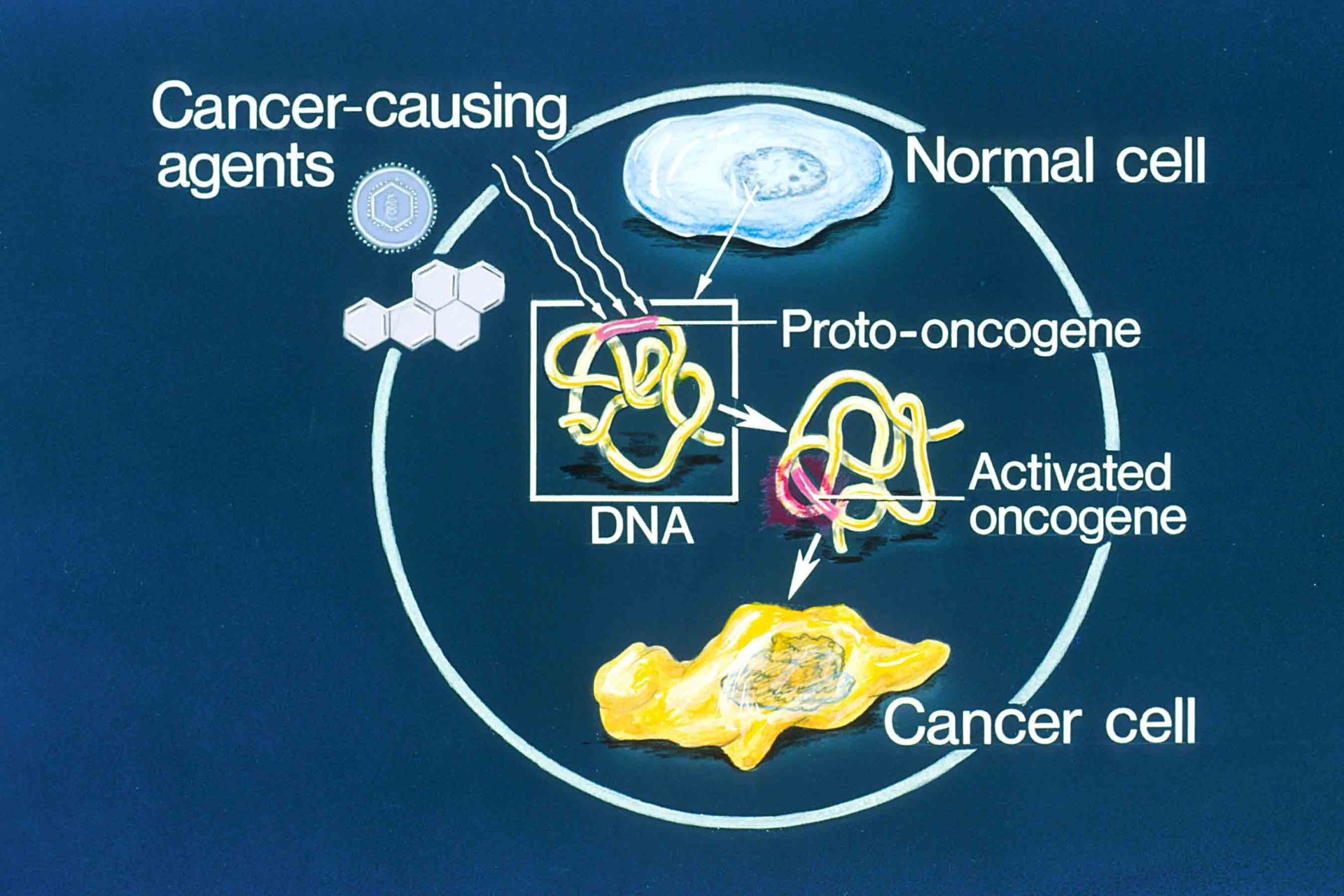
انكوژنها (Oncogene) اولين ژنهاي سرطاني بودند كه كشف شدند. انكوژنها يا ژنهاي تومورزا ژنهاي تغيير يافتهاي هستند كه در حالت عادي پروتئينهايي را كه در كنترل رشد و تكثير سلولها نقش دارند، بيان ميكنند. اين ژنها در حالت عادي پروتوانكوژن ناميده ميشوند ولي در صورت بروز جهش در پروتوانكوژنها، آنها به انكوژنها تبديل ميشوند.
جهشهايي كه پروتوانكوژنها را به انكوژنها تبديل ميكنند، اغلب باعث بيان بيش از حد فاكتورهاي كنترلي، افزايش تعداد ژنهاي كدكنندهي آنها يا تغيير فاكتورهاي كنترلي بصورتيكه فعاليت فاكتورها، افزايش يابد يا نيمه عمر آنها در سلول زياد شود، ميشود. ابتدا انكوژنها در ويروسها كشف شدند كه انكوژنهاي ويروسي ناميده ميشوند. بهواسطهي جهش در پروموتر پروتوانكوژنها، آنها به انكوژنهاي فعال تبديل، بيان آنها زياد ميشود، تكثير سلولها افزايش مييابد و تومور ايجاد ميشود.
آنكوپروتئين
آنكوپروتئينها محصول پروتوانكوژنها هستند كه در حضور ژن سركوبگر تومور ايجاد ميشوند. در سلول هاي ديپلوئيدي طبيعي دو كپي از هر ژن سركوبگر وجود دارد. هر دو ژن اغلب غير فعالاند. انكوپروتئينها نقشهاي زيادي دارند؛ بعضي بهعنوان ليگاند عمل ميكنند و در سطح سلول گيرنده دارند و مانند فاكتورهاي رشد عمل ميكنند. برخي از آنها نيز بهعنوان گيرندههاي غشايي عمل ميكنند.
پروتوانكوژن
پروتوانكوژنها ژنهايي هستند كه برخي از آنها فاكتورهاي رشد سلول، رسپتورهاي فاكتورهاي رشد، فاكتورهاي رونويسي و فاكتورهاي كنترلكنندهي سيكل سلولي را كد ميكنند. برخي از ويروسها داراي ژنهايي مشابه انكوژنهاي سلولي هستند و در صورتي كه اين ويروسها وارد سلولهاي عادي شوند با بيان انكوپروتئينها، باعث سرطاني شدن سلولها ميشوند. انكوژنهاي ويروسي را بهصورت v-onc نشان ميدهند. براي مثال، ويروس Rous Sarcoma داراي v-scr و ويروس Rat sarcoma داراي v-ras است. محصول پروتوانكوژنها را انكوپروتئين مينامند. تغييرات ژنتيكي كه باعث توليد آنكوژنها و اختلالات ژنتيكي ميشود عبارتاند از:
- Chomosomal Translocation: مانند ژن Bcr و انكوژن Abl در سرطان مزمن خون
- Point mutation: مانند ژن Ras در سرطان روده بزرگ
- Deletion: مانند ژن Erb-B در سرطان سينه خانمها
- Amplification: مانند ژن N-myc در سرطان سلولهاي عصبي كودكان
- Insertional activation: مانند ژن C-myc در سرطان حاد خون
سرطان مزمن خون اغلب در سنين بالا اتفاق ميافتد و شامل تعويض مادهي ژنتيكي دو كرومواخبار تخصصي ۹ و ۲۲ است. اين حالت منجر به توليد يك بيوماركر بهنام (ph1) كه در ۹۵ درصد اين بيماران ديده ميشود كه به تشخيص صحيح نوع بيماري كمك موثري ميكند. اتصال ژن Bcr به آنكوژن Abl باعث بهوجود آمدن تركيب جديد ژني ميشود كه پروتئين حاصل و ساختهشده از آن، خاصيت پروتئين كيناز (protein kinase) دارد. در سال ۱۹۹۰ شكل فضايي و سهبعدي اين آنزيم مشخص و داروي Gleevec توسط سازمان FDA آمريكا تصويب شد. اين دارو Gleevec يا Imatinib نام دارد كه از مادهي شيميايي 2-phenylamino pyrimidine ساخته شده است. مكانيسم عمل اين دارو به اين نحو است كه به محلهاي فعال آنزيم يادشده ميچسبد و باعث جلوگيري از فعاليت اين آنزيم ميشود كه نهايتا منجر به عدم رشد سلول سرطاني ميشود. اين اولين داروي ضدسرطاني است كه منحصرا آنزيم سلولهاي سرطاني را هدف قرار ميدهد. اين دارو همچنين روي تومورهاي دستگاه گوارش و دستگاه توليدمثل هم مؤثر بوده است و آنزيمهاي توليدشده توسط ژنهاي Erb-B ،Kit و EGFR را هدف قرار ميدهد.
۲. مرگ برنامهريزيشده (آپوپتوزيس)
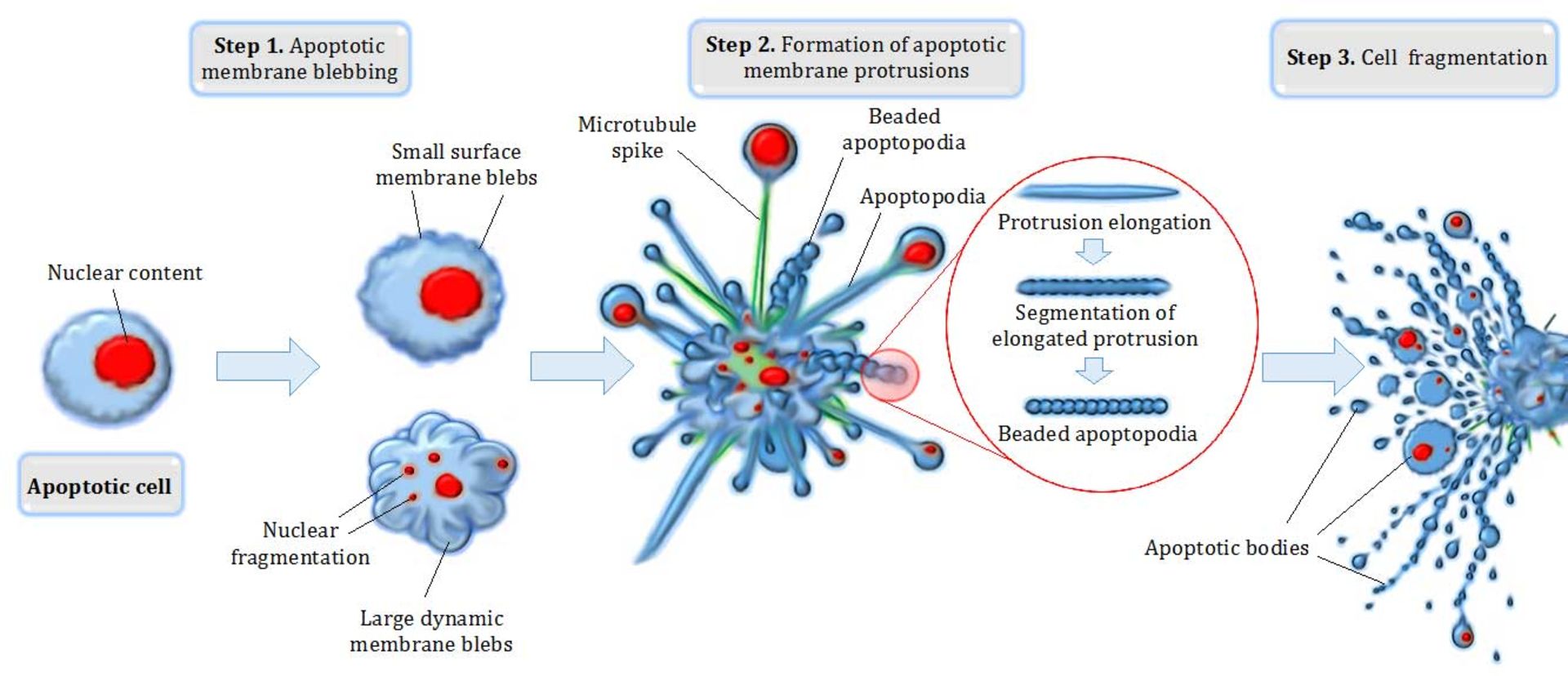
آخرين راه فرار از سرطاني شدن سلولها انتخاب مرگ يا خودكشي برنامهريزي شده (Apoptosis) است. تخريب غشاي هسته و سيتوپلاسم سلول منجر به قطعهقطعه شدن سلول ميشود كه سريعا توسط فاگوسيتها بلعيده و از محيط ربوده ميشوند. در يك انسان بهطور ميانگين هر روز ۶۰ ميليون سلول با مرگ برنامهريزيشده ميميرند. ازدياد عمل در اين مرگ باعث تحليل بافتها و فقدان عمل موجب توليد سلولهاي سرطاني ميشود. عوامل زيادي سبب توليد اين خودكشي سلولي ميشود كه از آن جمله ميتوان به توكسينها، هورمونها، سيتوكينها، اشعهها، حرارت، عفونت ويروسي، كمبود اكسيژن، محروميت غذايي، ازدياد غلظت كلسيم داخل سلول و نيتريك اكسيدها اشاره كرد. چندين ژن در توليد آپوپتوزيس نقش مهمي را ايفا ميكنند، مانند Bcl-2, P53, Bcl-XL, Bax, Bak, Bad, Bim و Mcl-1. ژن Bcl-2 روي كرومواخبار تخصصي 18q21 قرار دارد كه وزن مولكولي پروتئين آن ۲۵ كيلودالتون و طولش ۲۳۹ اسيدآمينه است.
اين پروتئين فعاليت آنزيمهاي كاسپاز را تنظيم ميكند. اين پروتئين Bcl-2 باعث رهايي سيتوكروم C از ميتوكندريها كه منجر به فعال شدن كاسپاز ۹ و سپس كاسپاز ۳ و در نهايت به خودكشي سلول ختم ميشود. پروتئين Bcl-2 ميتواند هم در ايجاد و هم ممانعت از آپوپتوزيس نقش بازي كند. همكاري پروتئينهاي Mcl-1 ،Bcl-2 و Bcl-XL عمل ضدآپوپتوزيس دارند. درحاليكه ديگر پروتئينهاي Bax, Bak, Bad, Bim در ايجاد آپوپتوزيس نقش موثري را بازي ميكنند. براي جلوگيري از آپوپتوزيس بايد از عمل Fas و Bcl-2 جلوگيري كرد و غلظت IAPS را بالا برد. همچنين پروتئين AKt-kinase باعث بقاي زندگي سلولها ميشود. فسفوريلاسيون ژن Akt باعث جلوگيري از عمل Bax و پروتئين Akt باعث فعال شدن مولكول IKKA ميشود كه اين امر مولكول NF-KB را فعال ميكند و در نهايت منجر به بيان ژنهايي ميشود كه ضد آپوپتوزيس هستند.
آخرين راه فرار از سرطاني شدن سلولها، انتخاب آپوپتوزيس است
۳. ژنهاي ترميمكننده
ژنهاي ترميمكننده بهطور طبيعي پروتئينها و آنزيمهايي را ميسازند كه خاصيت ترميمكنندهي ژنهاي صدمه ديده را دارند. هنگامي كه خودشان موتاسيوندار شوند آن موقع نميتوانند نواقص ژنهاي ديگر را بازسازي كنند. همهي ژنهاي سلول بهطور طبيعي تحت حملات عوامل محيطي و متابوليكي قرار ميگيرند كه نتيجهي صدمات متوالي به اين ژنها نياز مبرمي نسبت به پروتئينهاي ترميمكننده پيدا ميكنند. تا بهحال بيش از ۳۰ نوع پروتئينهاي ترميمكننده شناسايي شدهاند كه همگي در تصحيح نواقص ژنتيكي سلولها نقش زيادي دارند. بيش از يك ميليون صدمات ژنتيكي در روز به ژنهاي هر سلول زده ميشود كه اگر اين نواقص ترميم نگردد سلول يا سالخورده ميشود، يا خودكشي ميكند يا به سرطان تبديل ميشود. بهترين مثال ژن ترميمكننده، ژن BRCA-1 است كه روي كرومواخبار تخصصي 17q21 قرار دارد.
اين ژن پروتئيني ميسازد كه چندين خاصيت دارد كه يكي از اين خواص، قدرت تصحيح ژنهاي معيوب است. اين پروتئين حاوي مولكول Zinc finger است كه بيان ژنهاي وابسته را كنترل ميكند. پروتئينهاي BRCA-1 و RDA-1 ميتوانند شكستگيهاي دو رشته DNA را تعمير كند. ژن BRCA-1 در هنگام موتاسيون داشتن به توليد و رشد سلولهاي سرطان در سينه خانمها بهصورت وراثتي نقش موثري دارد. ژن BRCA-2 هم كه روي كرومواخبار تخصصي 13q14 است پروتئيني توليد ميكند كه همانند پروتئين BRCA-1 عمل ميكند. تا به حال بيش از يك هزار موتاسيون ژنتيكي در ژن BRCA-2 و BRCA-1 شناسايي شده است. ژن BRCA-1 در سال ۱۹۹۰ توسط Dr.king كشف و در سال ۱۹۹۴ كلون شد.
۴. ژنهاي سركوبگر توموري
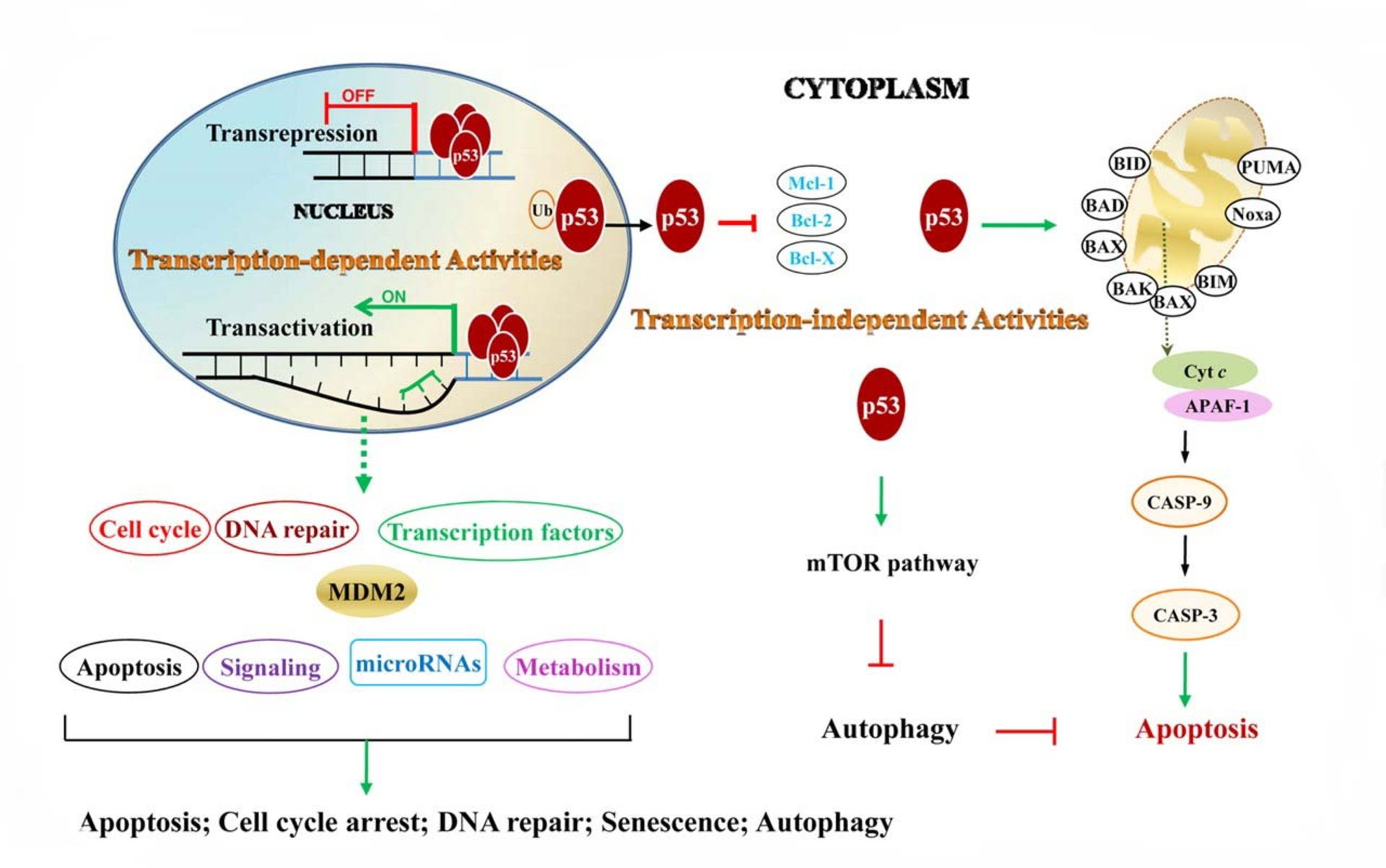
نبود ژنهاي مهاركنندهي توموري يا سركوبگر توموري باعث تقسيم غيرقابل كنترل سلولهاي سرطاني ميشود. ژن مهاركنندهي p53 روي كرومواخبار تخصصي 17P13.1 قرار دارد. طول اين ژن ۲۰ هزار bps است كه پروتئين به طول 393 اسيد آمينه ميسازد. ژن P53 كه در سال ۱۹۹۳ بهنام مولكول سال و ژن نگهبان شناخته شد بهطور طبيعي تقسيم ميشود و رشد سلول را تحت انديشه متخصصين كامل دارد. روي اين اصل موتاسيون ژن P53 در بيش از ۶۰ درصد بافتهاي سرطاني ديده ميشود. بيش از ۳۵ نوع ژنهاي مهاركننده تا به امروز شناسايي و گزارش شدهاند. وظايف پروتئين P53 در حال طبيعي تنظيم تقسيم سلولها، خودكشي سلولها، مسن شدن سلولها، عروقسازي، تمايز يافتن سلولها و متابوليسم DNA است. بيش از ۲۶ هزار موتاسيون ژنتيكي در ژن p53 گزارش شده است. بيشتر اين موتاسيونها در ناحيه DNA-binding اتفاق ميافتد و درنتيجه ژنهاي تحت كنترل p53 نميتوانند نسخهبرداري كنند. همكاري پروتئين p53 با دو پروتئين CDK1-P2 و CDC2، سلولهاي سرطاني را در مراحل G1 و G2 تقسيمسلولي نگه ميدارد.
نبود ژنهاي مهاركنندهي توموري باعث تقسيم غيرقابل كنترل سلولهاي سرطاني ميشود
پروتئين p53، هم مهاركننده و هم ارتقادهندهي سلولهاي سرطاني است. پروتئين p53 پس از آسيب ژنهاي ديگر به DNA متصل ميشود و ژن WAF1 را فعال ميكند. اين ژن، پروتئين P21 را توليد ميكند و به پروتئين CDK2 ميچسبد و اجازهي ورود P21 به مرحلهي بعدي تقسيم سلولي را نميدهد. پروتئين p53 يك تركيبي از شبكهي حوادث مولكولي است كه در توليد سلولهاي سرطاني نقش مهمي را بازي ميكند. پروتئين p53 فعال از طرف ترمينال N از دو طريق، فسفوريلاسيون ميشود. ازطريق MAPK پروتئين و ازطريق ATM ،ATR و LHK پروتئين. وقتي كه p53 فسفوريلاسيون ميشود خاصيت چسبيدن به MDM2 را از دست ميدهد. پروتئين pint شكل ساختمان p53 را تغيير ميدهد و به عدم اتصال p53 به MDM2 كمك ميكند. وقتي كه ژن p53 فاقد ضربات محيطي است، مقدار p53 پائين ميرود. پروتئين MDM2 به p53 ميچسبد و از عملش جلوگيري ميكند و آنرا به سيتوپلاسم سلول انتقال ميدهد. عمل ضدسرطان p53 از سه مسير انجامپذير است:
- پروتئين p53 باعث تحريك پروتئينهاي ترميمكنندهي DNAr ميشوند كه به آسيبهاي وارد شده به ژنها رسيدگي شود.
- پروتئين p53 باعث تحريك مرگ برنامهريزيشده ميشود (وقتي كه سلولهاي آسيبديده غيرقابل بازسازي باشند).
- پروتئين p53 تقسيم سلولي را در مرحله G1/S نگه ميدارد تا فرصتي براي تعمير باشد.
تشخيص سرطان
در صورتي كه غدهاي در پستان خود لمس كردهايد، اولين قدم در تشخيص، معاينه توسط پزشك جراح است. او به شما خواهد گفت كه آيا چنين تودهاي واقعا وجود دارد يا خير و اگر وجود دارد، بيشتر احتمال دارد كه اين توده خوشخيم باشد يا سرطاني. پس از معاينه، پزشك ممكن است مراحل تشخيصي بعدي را براي شما درخواست كند. هرگز روشهاي تشخيصي را بدون انديشه متخصصين پزشك و بهطور خودسرانه انجام ندهيد. ممكن است در مواردي لازم باشد آن آزمايش به شكل ديگري انجام شود.
روشهاي تصويربرداري متعددي وجود دارند كه پزشك بهوسيلهي آن ميتواند پستان را مطالعه و در مورد تودهي احتمالي موجود در آن قضاوت كند. مهمترين اين روشها كه به فراواني استفاده ميشوند، ماموگرافي و سونوگرافي و در مرحلهي بعدي MRI هستند. آزمايش خون نيز گاهي اوقات منجر به شناسايي سرطان ميشود. ديگر آزمايشها مثل اسكن استخواني و بسياري ديگر نيز شايد به قصدي ديگر انجام شوند، اما در نهايت اگر اشكالي وجود داشته باشد ميتوانند كمككننده باشند.
روشهاي درمان سرطان

۱. جراحي
جراحي يك روش سريع براي حذف تومورهاي سرطاني از داخل بدن بيمار است. اين روش براي تورموهايي به كار ميرود كه گسترش پيدا نكردند يا در اصطلاح پزشكي، متاستاز ندادهاند. جراحي يك روش تضمين شده براي حذف سلولهاي سرطاني نيست و در صورت لاخبار تخصصي، پزشكان بخشهايي از لنف سالم را هم برميدارند تا از عدم سرايت سرطان مطمئن شوند. گاهي به جاي جراحي از پرتوهاي ليزر استفاده ميكنند يعني با استفاده از پرتوهاي قوي ليزر، تورمور سرطاني را ميسوزانند كه در سرطانهايي مانند رحم و پوست پركاربردتر است.
۲. پرتو درماني
در پرتودرماني از پرتوهاي پرانرژي براي از بين بردن سلولهاي سرطاني استفاده ميشود. پزشكان انواع مختلفي از روشهاي پرتودرماني و در برخي موارد تركيبي از اين روشها را بهكار ميبرند.
- پرتودرماني خارجي: در اين روش تشعشعها از دستگاه بزرگي ميتابد كه در خارج از بدن قرار دارد. بيشتر افرادي كه از اين روش درمان استفاده ميكنند بايد به مدت چند هفته، هفتهاي ۵ روز، براي درمان به بيمارستان يا كلينيك مراجعه كنند.
- پرتودرماني داخلي: در اين روش منشا تشعشعها، مواد راديواكتيوي است كه درون محفظههاي ريز، سوزنها يا لولههاي نازك پلاستيكي قرار داده شدهاند و داخل بافت يا اطراف آن كار گذاشته ميشوند. معمولا بيمار طي درمان در بيمارستان، بستري ميشود. محفظه راديواكتيو اغلب چند روز در بدن بيمار باقي ميماند.مقالهي مرتبط:نيمي از بازماندگان سرطان اطفال، دچار اختلالات هورموني خواهند شد
- پرتودرماني تمام بدن: در اين روش منشا تشعشعها مايع يا كپسولي حاوي مواد راديواكتيو است كه به تمام قسمتهاي بدن ميرسد. بيمار اين مايع يا كپسول را ميبلعد يا به وي تزريق ميشود. از اينگونه پرتودرماني جز براي درمان سرطان، براي مهار درد شديد ناشي از سرطان پيشرفته نيز استفاده ميشود. امروزه بعضي از سرطانها را به اين شيوه درمان ميكنند.
۳. شيمي درماني
بهعنوان بخشي از فرآيندهاي طبيعي بدن، سلولها بهصورت مداوم از راه تقسيم شدن، جايگزين ميشوند. داروهاي شيمي درماني در توانايي تقسيم شدن سلول سرطاني مداخله ميكنند. در اين راستا ممكن است فقط از يك دارو يا تركيبي از چند دارو استفاده شود. اين داروها ممكن است به صورت مستقيم وارد جريان خون بشوند و به سلولهاي سرطاني سرتاسر بدن حمله كنند؛ يا به صورت اختصاصي فقط قسمتهاي سرطاني را هدف قرار دهند. عوارض جانبي اين روش درماني به نوع دارو و ميزان مصرف آن بستگي دارد. اين داروها بر سلولهاي سرطاني و ديگر سلولهايي كه به سرعت تقسيم ميشوند تأثير ميگذارد و ممكن است عوارض زير را داشته باشند:
- سلولهاي خوني: هنگاميكه دارو به سلولهاي خوني سالم آسيب برساند، خطر عفونت، كبودي يا خونريزي بيشتر ميشود و بيمار احتمالاً احساس ضعف و خستگي شديد خواهد كرد.
- سلولهاي ريشهي مو: شيميدرماني ممكن است موجب ريزش مو شود بااينحال موهاي بيمار دوباره رشد خواهند كرد اما اغلب رنگ و جنسشان با موهاي قبل متفاوت است.
- سلولهاي پوشاننده دستگاه گوارش: شيميدرماني ممكن است باعث كماشتهايي، حالت تهوع، استفراغ، اسهال يا دردهايي در دهان و لبها شود. برخي از اين داروها بر باروري تأثير ميگذارند. بانوان ممكن است ديگر نتوانند بچهدار شوند و مردان هم شايد قدرت باروري خود را از دست بدهند. با وجود اينكه عوارض جانبي شيميدرماني گاه دردناك و نگرانكننده است اما معمولا موقتي است و پزشك ميتواند آنها را درمان يا مهار كند.
۴. ايمونوتراپي
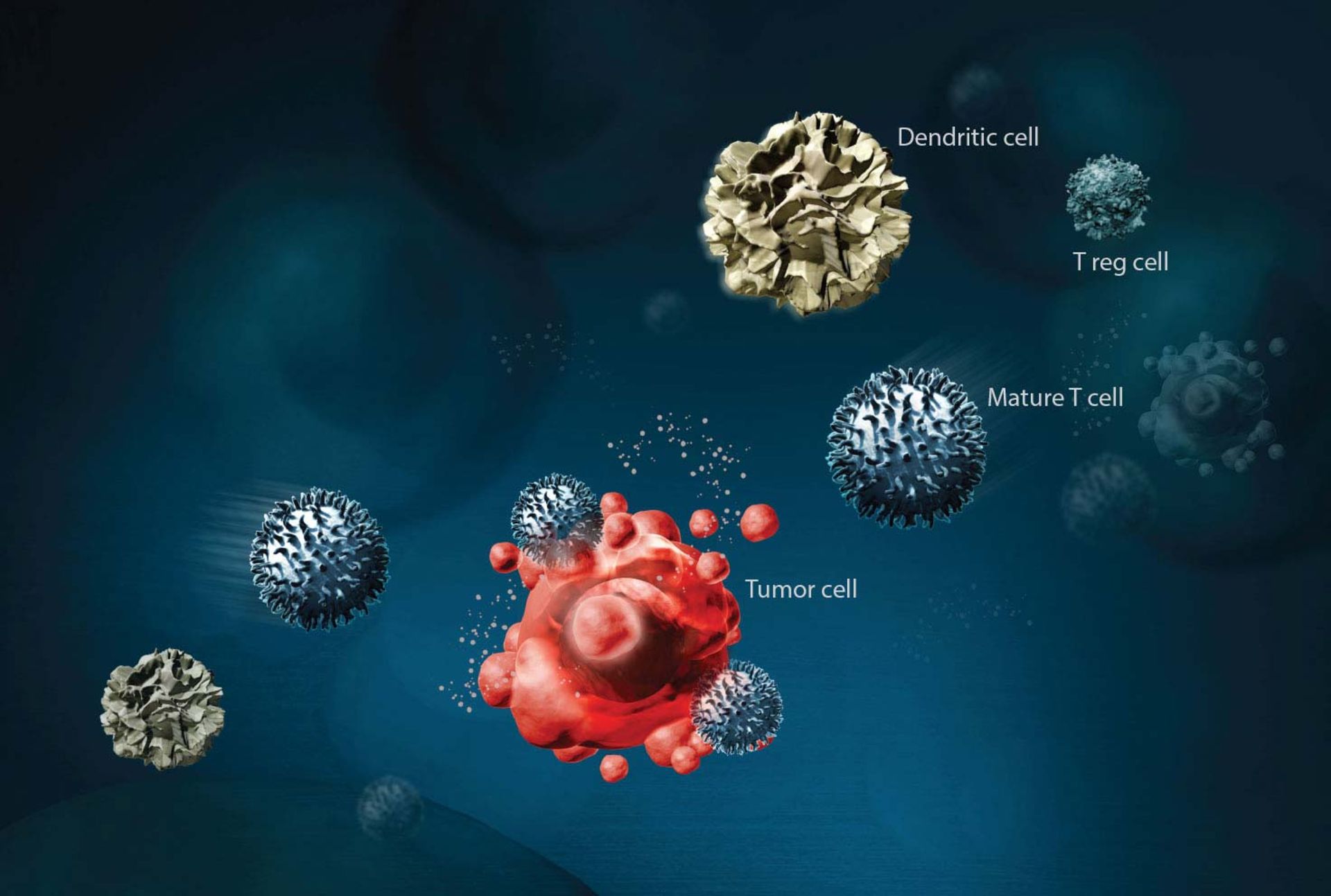
ايمونوتراپي درماني است كه از قسمتهاي مشخص دستگاه ايمني فرد براي مبارزه با بيماريهايي مانند سرطان استفاده ميكند. روش كار به اين شكل است كه سلولهاي T را از بدن بيمار خارج ميكنند. سلولهاي T نوعي گلبولسفيد هستند كه مهمترين ابزار بدن براي مبارزه با بيماريهاي عفوني و سرطان محسوب ميشوند. بعد از خارج كردن اين سلولها، مهندسان ژنتيك وارد كار ميشوند و با تغييري در سلولهاي T و اضافه كردن آنتيژن مصنوعي، اين سلولها را مجهز به راداري ميكنند تا قدرت پيدا كردن سلولهاي سرطاني را داشته باشد. سلولهاي سرطاني حاوي نوع خاصي پروتئين هستند كه اين رادار قدرت شناسايي آن را دارد. گلبولهاي سفيد مجهزشده، دوباره وارد بدن ميشوند تا به جنگ سلولهاي سرطاني بروند. ايمنيدرماني به چند صورت انجام ميپذيرد:
در ايمونوتراپي به سلولهاي T فرد بيمار، آنتيژن مصنوعي اضافه ميشود
- تحريك سيستم ايمني شما براي عملكرد بهتر يا هوشمندانهتر براي حمله به سلولهاي سرطاني
- دادن تركيباتي مانند پروتئينهاي دستساز دستگاه ايمني به بدنتان
بعضي انواع ايمونوتراپي، بيولوژيكتراپي يا بيوتراپي ناميده ميشود. ايمونوتراپي شامل درمانهايي است كه به روشهاي مختلف عمل ميكنند. تعدادي به سيستم ايمني بدن در مسيري عمومي كمك ميكنند. بقيه اختصاصا به سيستم ايمني براي حمله به سلولهاي سرطاني، كمك ميكنند. ايمونوتراپي براي تعدادي از سرطانها كارآمدتر است ولي بانديشه متخصصين ميرسد براي بقيه سرطانها وقتي با ديگر روشهاي درماني تلفيق شود كارآمدتر خواهد بود. انواع اصلي ايمونوتراپي كه اكنون براي درمان سرطان استفاده ميشود عبارتاند از:
- پادتنهاي مونوكلونال: اينها ورژن دستساز پروتئينهاي دستگاه ايمني هستند. پادتنها ميتوانند در درمان سرطان بسيار مفيد باشند. آنها ميتوانند طوري طراحي شوند كه به قسمتهاي مشخصي از سلول سرطاني حمله كنند.
- مهاركنندههاي نقاط بازرسي ايمني: اين داروها اساسا ترمز دستگاه ايمني را ميگيرند كه به شناسايي و حمله به سلولهاي سرطاني كمك ميكند.
- واكسنهاي سرطان: واكسنها موادي هستند كه به بدن تزريق ميشوند تا پاسخ سيستم ايمني را دربرابر بيماريهاي مشخص موجب شوند. ما اغلب فكر ميكنيم واكسنها به افراد سالم تزريق ميشوند تا به جلوگيري از عفونتها كمك كنند. ولي تعدادي از واكسنها ميتوانند به درمان و جلوگيري از سرطان كمك كنند.
- ايمونوتراپيهاي غير اختصاصي: اين درمانها سيستم ايمني را در يك مسير كلي تقويت ميكنند ولي اين درمان به سيستم ايمني براي حمله به سلولهاي سرطاني كمك ميكند.
۵. ژن درماني
اگرچه در ابتدا از ژندرماني بهعنوان روشي براي درمان سرطان ياد نميشد، اما در واقع با فرايند مورد مباحثه ميتوان تحولي در اين حوزه ايجاد كرد. پزشكان و پژوهشگران از مهندسي ژنتيك براي برنامهريزي مجدد سلولهاي ايمني لنفوسيت T، بهمنظور درمان انواع خاصي از سرطان استفاده ميكنند. اين شيوهي درماني به سرعت جايگاه خود را در دنياي پزشكي پيدا كرده است، اما در كنار عملكرد قوي، خطرات زيادي را نيز به همراه دارد. البته روشهاي نوين ويرايش ژن ميتوانند تا حد زيادي اين خطر را كاهش دهند. طي سال ۲۰۱۶ تيمي از پژوهشگران آمريكايي تصميم گرفتند از روش CRISPR براي تقويت سلولهاي لنفوسيت T و درمان سرطان استفاده كنند. بعدا مشخص شد «شان پاركر» ميلياردر و كارآفرين عرصهي تكنولوژي سرمايهي مورد نياز اين پژوهش را تأمين ميكند. ژنها كه روي كرمواخبار تخصصيها قرار دارند، واحدهاي فيزيكي و كاركردي پايهاي بدن هستند.
با جهشهاي ژنتيكي مخرب، پروتئينها علملكرد طبيعي خود را از دست ميدهند و باعث ايجاد بيماري ژنتيكي ميشوند
ژنها تواليهاي اختصاصي بازهايي هستند كه چگونگي ساخت پروتئينها را رمزبندي ميكنند. گرچه ژنها بيشتر مورد توجه قرار ميگيرند، اما اين پروتئينها هستند كه اغلب كاركردهاي حياتي را انجام ميدهند و حتي اكثريت ساختارهاي سلولي را تشكيل ميدهند. هنگامي كه ژنها به نحوي تغيير پيدا كنند كه پروتئينهاي رمزبنديشده به وسيلهي آنها نتوانند كاركردهاي طبيعيشان را انجام دهند، بيماريهاي ژنتيكي بهوجود ميآيند. ژندرماني تكنيكي است براي تصحيح ژنهاي معيوبي كه مسئول ايجاد بيماري هستند. پژوهشگران ممكن است يكي از چندين رويكرد موجود را براي تصحيح ژنهاي معيوب به كار ببندند. ژن طبيعي ممكن است به درون يك محل غيراختصاصي درون ژنوم كاشته شود تا يك ژن بيكاركرد را جايگزين كند؛ اين روش يك رويكرد رايج است. يك رويكرد ديگر تعويض ژن غيرطبيعي ازطريق بازتركيبي هومولوگ است. ژن غيرطبيعي را ميتوان ازطريق جهش معكوس انتخابي ترميم كرد، كه باعث ميشود، ژن به كاركرد طبيعياش بازگردد. تنظيم يك ژن خاص (ميزاني را كه يك ژن خاموش و روشن ميشود) را نيز ميتوان تغيير داد.
۶. هورمون درماني
اين روش كه درمان غدد درونريز هم ناميده ميشود سرطانيهايي كه از هورمون استفاده ميكنند را هدف قرار ميدهند و به دو صورت عمل ميكنند: از توليد هورمون در بدن جلوگيري ميكنند يا شيوه عملكرد هورمون را تغيير ميدهند. گاهي اوقات لازم است عضوهاي هورمونساز مانند تخمدان و بيضه را خارج كنيد.
پزشكان اين روش را كنار درمانهاي ديگر استفاده ميكنند تا پيش از جراحي يا درمان تومورها كوچك شوند يا سلولهاي سرطاني كه به نقاط ديگر بدن گسترش يافتهاند را از بين ببرند. اين روش احتمال بازگشت سرطان را كاهش ميدهد. رشد بعضي سرطانها بستگي به ترشح نوعي هورمون در بدن دارد مثل سرطان سينه در خانمها. درمورد چنين سرطانهايي از هورمون درماني استفاده ميشود كه در واقع از ترشح هورموني كه باعث رشد سرطان ميشود، جلوگيري ميكند. مثلا براي زنان مبتلا به سرطان سينه داروهاي ضداستروژني تجويز ميشود.
۷. سلول درماني
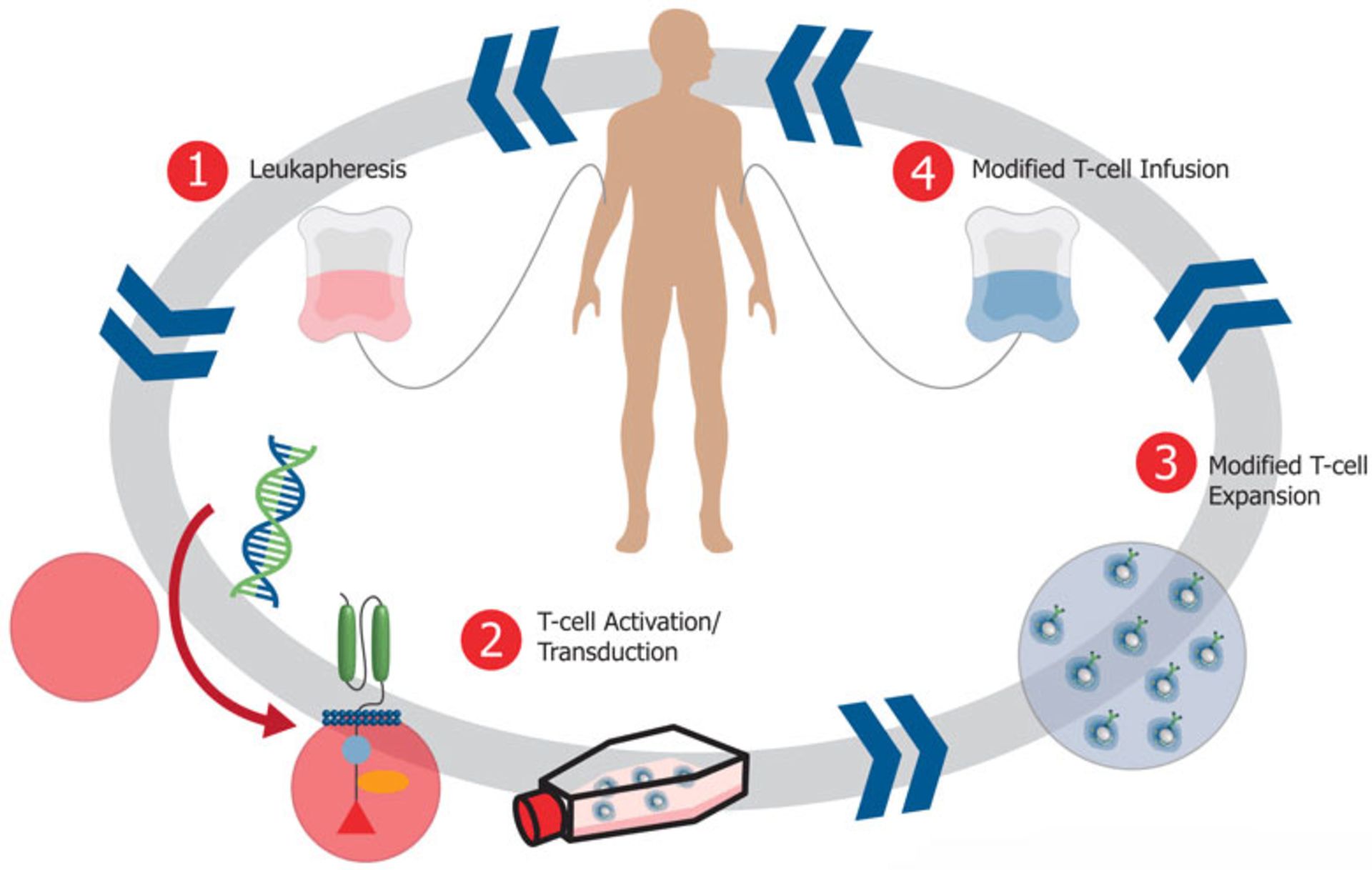
سلول درماني كه درمان سلولي يا سيتوتراپي (cell therapy) به پيوند سلول زنده از خود فرد يا فرد سالم ديگر با هدف بازسازي بافت بدن، گفته ميشود. براي نمونه سلولهاي T كه قادرند ازطريق ايمني سلولي (cell-mediated immunity) با سلولهاي سرطاني مبارزه كنند، ميتوانند بهمنظور ايجاد ايمني در دورهي درمان، به بيمار تزريق شوند. كشف و معرفي سلولهاي بنيادي و همچنين سلولهاي پيشساز بهخصوص سلولهاي بنيادي خونساز اين روش را تبديل به يك روش درماني مؤثر در درمان بسياري از سرطانها و نارساييهاي توليد سلولهاي خوني در مغز استخوان كرده است. سلولهاي بنيادي مادر همه سلولهاست و توانايي تبديل به همه سلولهاي بدن را نيز دارد.
در سلتراپي، سلولهاي سالم از خود فرد يا فرد سالم ديگر براي هدف بافتسازي پيوند زده ميشود
اين سلولها داراي توانايي خودنوسازي و تمايز به انواع سلولها مثل سلولهاي خوني، قلبي، عصبي و غضروفي هستند. سلولدرماني به پيوند سلول زنده از خود فرد يا فرد سالم ديگر با هدف بازسازي بافت بدن گفته ميشود. سلولها كارخانههاي قدرتمندي هستند كه ميتوانند اثرات درماني را ازطريق روشهاي متعددي اعمال كنند. سلولها ميتوانند در محل آسيب لانهگزيني كنند، مواد محرك رشد ترشح كنند و در برخي موارد به سلولهاي ديگري تبديل شوند. اين تطبيقپذيري باعث ميشود سلول درماني بهطور قدرتمندي عمل كند و امكان بالايي براي درمان بيماريهاي غيرقابل برگشت فراهم كند. امروزه دو دستهي مختلف از سلولدرماني شناخته شده است:
- اولين دسته از سلول درماني كه پايهگذاري شد، سلول درماني در پزشكي اصلي (mainstream medicine) است كه در آن سلولهاي انساني از يك دهنده به بيمار پيوند زده ميشوند. پژوهشهاي گستردهاي در اين روش در حال انجام است. چنين پژوهشهايي زماني كه روي جنين انسان انجام شود ممكن است مباحثهبرانگيز باشد.
- دسته ديگر، سلول درماني در پزشكي جايگزين (alternative medicine) است كه در آن از تزريق پيوستهي سلولهاي جانوري با هدف درمان بيماريها استفاده ميشود. انجمن سرطان آمريكا بيان كرده است كه هيچ مدرك پزشكي اثربخشي اين روش را حمايت نميكند و اين روش ميتواند پيامدهاي مرگباري داشته باشد.
۸. نانو درماني
امروزه فناوري نانو به كمك تشخيص و درمان اين بيماري آمده است طوري كه سبب شده است تا سلولهاي سرطاني در حد نانومتر تشخيص داده شوند و با كمك فناوري نانو از بين برده شوند. تشخيص سرطان در مراحل اوليه، در بهبود روشهاي درماني آن بسيار حائز اهميت است، در حال حاضر تشخيص و شناسايي سرطان معمولا براساس تغييرات سلولها و بافتها صورت ميگيرد كه اين كار با آزمايشهاي باليني پزشكي يا روشهاي معمول عكسبرداري قابل انجام است. نانوذرات و نانوابزارها نقشي بينظير و حياتي را در تبديل دانش به پيشرفتهاي مفيد باليني در زمينه تشخيص و درمان سلولهاي سرطاني ايفا ميكنند، كاري كه با انجام آن روند تشخيص و درمان و نهايتا پيشگيري از سرطان كاملاً متحول خواهد شد.
يكي از متخصصدهاي نانو ذرات، انجام همزمان دو عمل تشخيص تومور و رساندن دارو به تومور است
استفاده از اين نانوذرات بهعنوان دارو و براي درمان سلولهاي بدخيم سرطاني هيچگونه تأثير بدي بر سلولها و بافتهاي سالم بدن بر جاي نميگذارند. پس از رسيدن اين نانوذرات به تومورها، داروهاي درون آنها به وسيله نوارهاي باريك نور ليزر فعال ميشوند. اين نانوذرات همچنين قادر به مشخص كردن ميزان تأثير درمان بر سلولهاي بدخيم هستند. اين ايده بزرگ كه تنها با تزريق يك عامل بتوان تشخيص، درمان و گزارش در مورد ميزان اثر بخشي درمان را انجام داد، امري است كه فقط با كمك فناورينانو ميسر ميشود. يكي از اميدبخشترين متخصصدهاي نانو ذرات، ميتواند بهكارگيري آنها به منظور انجام همزمان دو عمل تشخيص تومور و رساندن دارو به تومور باشد. نانوذراتي كه در درمان سرطان به كار ميروند عبارتاند از:
- نقاط كوانتومي: در افزايش حساسيت روشهاي آزمايشگاهي تشخيص سرطان متخصصد دارند. همچنين مولكولهاي درختسانها سبب تسهيل در دارورساني ميشوند. اين مولكولها قابليت بالايي در شناسايي و درمان بهطور همزمان دارند و در ضمن داراي سطح وسيعي هستند كه بهوسيلهي آنها امكان اتصال عوامل درماني يا ساير مولكولهاي فعال زيستي فراهم ميشود.
- نانو پوستهها: ساختاري با يك هستهي مركزي است كه غشاي نازكي از يك فلز، مانند طلا روي آن روكش شده است و با استفاده از يك ليزر بيروني و رساندن انرژي به نانوپوستهها در يك تومور امكان تخريب گرمايي يا عكسبرداري از آن مقدور است يا براي ترميم زخم متخصصد دارد. اين روش توسط پژوهشگران دانشگاه Rice در مدلهاي حيواني انجام شده است.
- نانو ذرات مغناطيسي: اكسيد آهن جزو اصلي نانوذرات مغناطيسي است. مهمترين مزيت استفاده از اين ذرات اندازهي كوچكتر از ۱۰۰ نانومتر آنها است. در واقع ذرات اكسيد آهن Fe304 (مگنتيت) به دليل سازگاري با سيستمهاي بيولوژيك از اهميت ويژهاي برخوردار است.
با كمك ميدان مغناطيسي ميتوان اين ذرات را به منطقه خاصي هدايت كرد كه اين امر باعث تسهيل در امر تصويربرداري براي تشخيص و همچنين درمان سرطان ميشود. به دليل اين ويژگيها، نانو ذرات مغناطيسي متخصصدهاي پزشكي فراواني را دارند. از ديگر متخصصدهاي نانو ذرات مغناطيسي، استفاده از آن براي انتقال DNA به داخل سلول، تصويربرداري MRI، درمان تودههاي سرطاني به كمك حرارت درماني، جداسازي مغناطيسي مواد و استفاده در مهندسي بافت است. با تجمع ذرات مغناطيسي در بافت سرطاني، تشخيص تومور با استفاده از MRI تا حد زيادي تسهيل ميشود و علاوه بر اين ميتوان از اين ذرات بهعنوان حامل داروهاي ضد سرطان استفاده كرد.
هم انديشي ها